文献解读|Cell Rep Med(11.7):多模态分析揭示了区分 EBV 阳性和 EBV 阴性移植后淋巴增生性疾病的肿瘤和免疫特征
✦ +
+
论文ID
原名:Multi-modal analysis reveals tumor and immune features distinguishing EBV-positive and EBV-negative post-transplant lymphoproliferative disorders
译名:多模态分析揭示了区分 EBV 阳性和 EBV 阴性移植后淋巴增生性疾病的肿瘤和免疫特征
期刊:Cell Reports Medicine
影响因子:11.7
发表时间:2024.12.17
DOI号:10.1016/j.xcrm.2024.101851
背 景
致癌的 Epstein-Barr 病毒 (EBV) 可破坏宿主免疫力,从而引发肿瘤,导致包括移植后淋巴增生性疾病 (PTLD) 在内的恶性肿瘤。PTLD 也可能在没有 EBV 的情况下发生,但 EBV(+) 和 EBV(−) B 细胞 PTLD 的生物学差异以及相关的宿主-EBV-肿瘤相互作用仍不太清楚。
实验设计
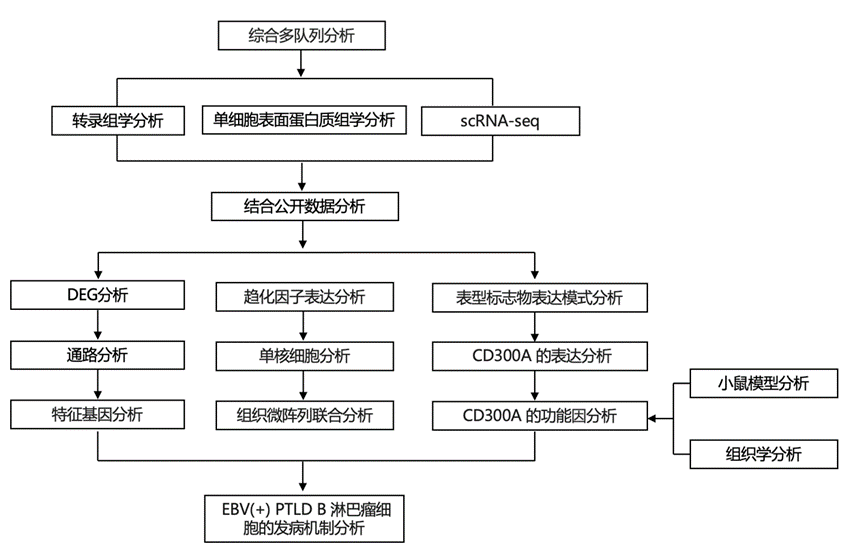
结 果
01
PTLD 转录组谱的综合多队列分析
研究团队采用了综合多模态方法,以确定 EBV(+) 和 EBV(-) PTLD 中 B 淋巴瘤细胞和 TME 的显著特征。为了确定 B 细胞移植后淋巴增生性疾病 (PTLD)中的肿瘤和肿瘤微环境 (TME) 转录图谱,他们收集了三个公开数据集,其中包含来自三家机构的 EBV(+)和 EBV(-)PTLD 病变患者的 60 个新鲜冷冻样本的完整转录组谱。虽然这些样本反映了PTLD 中 B 细胞淋巴细胞增生的异质性,但大多数是单形性弥漫大 B 细胞淋巴瘤 (DLBCL),这是 PTLD 最常见的临床亚型。
使用 MetaIntegrator 对这三个数据集进行综合多队列分析,确定了 EBV(+) PTLD 和 EBV(-) PTLD 之间 189 个显著差异表达基因 (DEG)(图 1 A),其中与 EBV(-) PTLD 患者相比,EBV(+) PTLD 患者中有 113 个上调,76 个下调。这 189 个基因在针对 EBV(+) 或 EBV(-) PTLD 分析的所有三个数据集中均具有一致的表达模式(图 1 B)。总的来说,他们将这些称为 EBV 相关 PTLD 基因特征。
EBV(+) PTLD 中过表达的 DEG 包括细胞因子和趋化因子(CCL3、CCL4、CCL8、IL15、IFNG)、免疫细胞表面标志(CD38、CD163、CD300A)、干扰素刺激基因(SIGLEC1、OAS1、OAS2、OASL、ISG15、IFI44L、IFIT3、IFIT5)、细胞毒性介质(PRF1、GNLY、GZMH)和抗病毒载脂蛋白 B mRNA 编辑催化多肽样 (APOBEC) 蛋白家族成员APOBEC3G,以及CTC-338M12.4(一种未知的非编码 RNA 基因)和PIK3R5(编码 PI3Kγ 的未充分研究的 p101 调节亚基,一种确定的PI3K/Akt/ mTOR通路中的关键激酶在 EBV(+) PTLD中具有组成性活性(图1 C)。相反,在 EBV(−) PTLD 中过表达的 DEG 包括抗凋亡转录因子基因(BCL6、 BCL11A)、趋化因子受体基因(CXCR5)、编码参与泛素介导的蛋白质降解的蛋白质的基因(UBE2A、CUL3和CUL4B)、致癌基因(BZW2、LMO2)和未知基因(CXorf56,也称为STEEP1)(图 1 C)。
为了深入了解与 EBV(+) 和 EBV(−) PTLD 相关的生物学过程,他们对特征基因进行了基因本体论 (GO) 通路富集分析。分别分析了在 EBV(+) PTLD 中上调或下调的 DEG。对于在 EBV(+) PTLD 中表达较高的 DEG,许多最富集的通路涉及病毒识别和免疫相关过程(图 1 D)。这些发现意味着,虽然移植后免疫抑制,宿主免疫力仍可检测并响应 EBV,和/或 EBV 诱导一组不同的免疫过程,从而导致 EBV(+) 和 EBV(−) PTLD 中的转录组差异。相比之下,EBV(−) PTLD 中表达较高的 DEG 与脂质代谢和 DNA 相互作用或 DNA 修复途径相关(图 1 D),表明 EBV(−) PTLD 与发生在免疫功能正常的个体中的 B 细胞淋巴瘤相似,后者具有更高的突变负担和异常代谢的特点。总体而言,这些数据进一步证明,EBV(+) 和 EBV(−) PTLD 之间不同的致癌驱动因素导致不同的基因表达模式,因此暗示EBV (+) 和 EBV(−) PTLD 的发展和持续存在不同的潜在生物学过程。

图1. 综合多队列分析确定了 189 个基因特征,可区分 EBV(+) PTLD 与 EBV(−) PTLD。
(A) 比较 EBV(+) 和 EBV(−) PTLD 病变样本的多队列基因表达分析概述。(B) EBV 相关 PTLD 特征中每个基因的 log2 转换效应大小值热图。(C) PTLD 肿瘤微阵列数据集基因表达数据的火山图。(D) EBV 相关 PTLD 特征中基因的通路过度表达分析。
02
EBV(+) PTLD B 细胞在转录组学上与 EBV(−) B 淋巴瘤细胞不同
由于多队列分析中的数据集包含新鲜冷冻 PTLD 肿瘤样本的转录组谱,因此每个样本都包含来自转化的 B 细胞的 RNA 转录本,以及病变内的背景组织、基质细胞和免疫浸润。为了阐明在有或没有 EBV 的情况下转化的 B 细胞之间的细胞内在差异,他们接下来通过微阵列基因表达分析研究了来自 EBV(+) PTLD 患者的 EBV(+) B 细胞淋巴瘤系的转录组,这些细胞的形态与 DLBCL 相对应,以及 EBV(-) DLBCL 细胞系。对所有七种 B 淋巴瘤系的转录组进行无监督聚类表明它们根据 EBV 状态进行分离(图 2 A),再次表明恶性 EBV(+) 和 EBV(-) B 细胞在其潜在生物学上显著不同。
他们鉴定了 1407 个 DEG(图2B-C),其中 613 个在 EBV(+) B 细胞淋巴瘤系中过表达。具体而言,上调的 DEG 包括编码多种趋化因子、分化聚类 (CD) 抗原、干扰素诱导基因和抗原呈递分子的基因,而下调的 DEG 包括编码与 DNA 组织或相互作用相关的蛋白质的基因,例如锌指、转录因子和着丝粒相关蛋白。GO 通路过度表达分析显示,EBV(+) B 细胞系中上调的 DEG 富集涉及病原体感染和免疫信号传导的通路,而下调的 DEG(即在 EBV(-) B 细胞系中表达较高的 DEG)与细胞周期和 DNA 相关通路最相关(图 2D)。
他们进一步筛选了 DEG,以确定 B 细胞淋巴瘤中与多队列分析中观察到的 EBV 相关 PTLD 基因特征重叠且表达模式一致的基因(图2E-F)。EBV(+) PTLD 患者和 B 细胞系中转录组表达一致的 DEG 主要与免疫过程有关,包括细胞因子/趋化因子基因(CCL3、CCL4、IL15)、抗病毒基因(APOBEC3G)、干扰素相关基因(ISG15、IFI44L、IFIT3、OAS1、OAS2)和免疫受体基因(CD300A、BTN3A1)。同时,在 EBV(−) PTLD 和 B 细胞系中表达同样增加的 DEG 反而包含具有抗凋亡功能的基因(BCL6、BCL11A、SYPL1、SYK)和与更具侵袭性的肿瘤表现相关的基因(SWAP70、GDI2、RBBP7)。这些转录组差异反映了 EBV 转化的 B 细胞协调免疫信号通路和 TME 内变化的能力,即使在没有与免疫浸润和背景基质组织相互作用的情况下也是如此,并且在 EBV(−) B 细胞恶性肿瘤的情况下,通过失调稳态过程增强其发展。EBV(+) PTLD B 细胞系趋化因子的表达和分泌增加,这与原发性 EBV(+) PTLD 病变的 TME 中单核细胞迁移增强和 CD163+单核细胞富集相关。

图2. EBV(+) PTLD 患者来源的 B 细胞系和 EBV(−) B 细胞系基因特征的独立验证。
(A) 根据转录组谱对 EBV(+) 和 EBV(−) B 细胞系进行聚类分析。(B) EBV(+) 和 EBV(−) B 细胞系基因表达数据的火山图。(C) EBV(+) 和 EBV(−) B 细胞系之间 1407 个 DEG 的差异倍数值热图。(D) EBV(+) B 细胞系中 DEG 的通路过度表达分析。(E) EBV 相关 PTLD 特征的效应大小与 EBV(+) 和 EBV(−) B 细胞系之间的相关性。(F) 使用 EBV(+) B 细胞系选择基因进行进一步体外和体内研究的策略概述。
03
EBV(+) B 细胞系趋化因子的表达和分泌增加
虽然对 EBV(+) PTLD 中的 TME 知之甚少,但有证据表明存在免疫炎症环境。为了更好地了解 EBV(+) B 细胞 PTLD 如何影响肿瘤-宿主细胞相互作用,他们最初重点研究可能有助于 TME 调节的 EBV(+) PTLD B 细胞 DEG。趋化因子基因CCL3、CCL3L1、CCL3L3和CCL4在 EBV(+) B 细胞淋巴瘤系和 EBV(+) PTLD 特征基因中上调(图3A)。他们在转录本水平(图 3B)和蛋白质水平(图 3C)上验证了它们在 EBV(+) B 淋巴瘤系中相对于 EBV(−) 淋巴瘤系的过表达。
鉴于这些趋化因子在免疫细胞募集方面的既定作用,他们推断 EBV(+) B 细胞 PTLD 分泌的这些因子可能会影响免疫浸润物的组成。因此,他们使用计算机模拟细胞混合物反卷积和原始多队列分析数据集上的基础矩阵免疫状态来估计每个样本中存在的各种免疫细胞亚群的比例。然后,他们对估计的免疫细胞比例进行了另一次多队列分析,以比较 EBV ( +) PTLD 和 EBV(-) PTLD 原发性病变之间的变化(图 3 D)。EBV(+) PTLD 病变中总单核细胞的比例显著高于 EBV(−) PTLD 病变,这主要是由于 EBV(+) PTLD 中 CD14 +单核细胞的显著富集(图 3 E)。
EBV(+) PTLD 中单核细胞比例的增加与之前的发现相吻合,即已知的单核细胞趋化因子 CCL3 和 CCL4 在 EBV(+) PTLD 中过度表达,这表明淋巴瘤衍生的趋化因子促进单核细胞浸润到 EBV(+) PTLD 病变中,从而改变 TME。他们使用单核细胞系 THP-1 进行了跨孔迁移测定,使用来自 EBV(+) 和 EBV(−) B 淋巴瘤细胞系的培养上清液作为趋化因子(图 3 F)。三种 EBV(+) PTLD 细胞系(AB5、JB7 和 JC62)的培养上清液诱导的 THP-1 迁移显著高于两种 EBV(−) B 淋巴瘤细胞系的上清液(图 3 G)。
为了确定其他分泌因子是否也会导致观察到的差异性单核细胞迁移,他们接下来通过 Luminex 检测评估了 EBV(+) 和 EBV(-) 培养上清液。根据细胞因子分泌谱对所有七种细胞系进行无监督层次聚类,结果显示 EBV 状态显著不同(图 3 H)。除 CCL3 和 CCL4 外,EBV(+) 细胞系还分泌多种细胞因子和趋化因子 (FLT3L、GM-CSF、白细胞介素 [IL]-27、CCL2、M-CSF、CXCL9 和 CCL5),其中许多在单核细胞募集方面发挥着已知作用,且分泌水平始终高于 EBV(-) 细胞系(图 3 H)。在转录水平上,CCL5和CSF1 (M-CSF) 是已确定在 EBV(+) B 细胞系中上调的 DEG 之一(图 2 B)。此外,THP-1 迁移指数与 FLT3L、GM-CSF、IL-27、CCL2 和 M-CSF 浓度呈正相关(图 3 I)。具体而言,EBV(+) B 细胞中分泌的 CCL2 与单核细胞迁移程度呈强正相关。这些数据表明 EBV(+) B 细胞淋巴瘤细胞产生的趋化因子可促进单核细胞浸润到 EBV(+) PTLD 的 TME 中。

图3. 与 EBV(−) B 细胞系相比,EBV(+) B 细胞系趋化因子的表达和分泌增加,这与单核细胞迁移增强相关。
(A) PTLD 肿瘤微阵列数据集中CCL3、CCL3L1、CCL3L3和CCL4表达的森林图。(B) 通过定量逆转录 PCR (RT-qPCR) 定量 EBV(+) 和 EBV(-) B 细胞系中CCL3、CCL3L1、CCL3L3和CCL4的相对基因表达。(C) EBV(+) 和 EBV(-) B 细胞系分泌 CCL3 和 CCL4,通过 ELISA 进行定量。(D) PTLD 肿瘤微阵列数据集的反卷积分析和多队列分析概述。(E) 根据 PTLD 肿瘤微阵列数据集估计的单核细胞比例的森林图。(F) 使用 EBV(+) 和 EBV(−) B 细胞系的细胞培养上清液进行跨孔迁移试验的实验示意图。(G) EBV(+) 和 EBV(−) 细胞系细胞培养上清液的 THP-1 迁移指数。(H) Luminex 细胞培养上清液检测中 log10 转换的平均荧光强度 (MFI) 值热图。(I) 细胞因子 MFI 值与 THP-1 迁移指数的相关性。
04
原发性 EBV(+) PTLD 病变的肿瘤微环境分析
为了直接评估原发性 EBV(+) 和 EBV(−) PTLD 肿瘤病变内的单核细胞浸润,他们通过索引 (CODEX)、免疫组织化学 (IHC) 和原位杂交 (ISH) 对来自人类 DLBCL PTLD 档案标本的福尔马林固定石蜡包埋 (FFPE) 组织微阵列进行了联合检测。与 EBV(−) PTLD 病变相比,EBV(+) 内的非 B/非 T 细胞中单核细胞/巨噬细胞标志物 CD14 的中位强度显著增加(图 4 A),这与多队列分析结果一致(图 3 E)。虽然CODEX 测定的 CD163 中位表达 在 EBV(+) PTLD 中未显著升高(图 4 A),但 CD163+ 细胞的比例在 EBV(+) PTLD 病变中趋于更高(图 4 B-C)。IHC 分析进一步证实了 CD163+ 细胞在 EBV 编码 RNA (EBER)+,即 EBV(+),PTLD 的 TME 中的富集(图 4 D)。潜伏膜蛋白 (LMP)1+ 和 Epstein-Barr 核抗原 (EBNA)+ PTLD 病例中 CD163+ 细胞的比例也有所增加。此外,在最初的多队列分析数据集中,CD163在 EBV 相关 PTLD 特征基因中也上调。总之,这些数据表明 EBV(+) PTLD 中 M2 样单核细胞的占主导地位可能会产生免疫抑制环境。与此一致,他们在 LMP1+ 或 EBNA+ PTLD 病例中观察到 CD3 + T 细胞和 CD4 + T 细胞的频率均显著降低(图 4 D)。此外,髓系限制性髓过氧化物酶 (MPO) 的中位表达(其酶活性与癌症较差的结果有关)在 EBV(+) PTLD 中也显著增加(图 4 A)。在 EBV(+) PTLD 病例中,潜伏期 III 病例更有可能具有较低的 CD3 + T 细胞比例。
总的来说, EBV(+) B 淋巴瘤细胞通过产生吸引单核细胞的趋化因子来改变 TME,导致 EBV(+) PTLD 中的免疫抑制环境由肿瘤相关 M2 单核细胞和 T 细胞比例减少驱动。

图4. 原发性 EBV(+) PTLD 病变的肿瘤微环境中 CD163+单核细胞增多。
(A) 原发性 EBV(+) 或 EBV(−) PTLD 病变内非 B/非 T 细胞中 CD14、CD163 和 MPO 的表达。(B) 原发性 EBV(+) 或 EBV(−) PTLD 病变内 CD163+ 细胞的百分比,通过 CODEX 定量。(C) EBV(+) 和 EBV(−) 单态性 PTLD(DLBCL 亚型)诊断活检的 FFPE 组织的 CODEX 图像。(D) EBV(+) 和 EBV(−) 单态性 PTLD(DLBCL 亚型)诊断活检的 FFPE 组织学。
05
单细胞表面蛋白质组学分析
接下来,他们重点研究了 EBV(+) 和 EBV(−) PTLD 中 B 淋巴瘤细胞的差异,方法是使用质谱流式细胞术 (CyTOF) 和识别 B 细胞表面分子的定制抗体组进行高维单细胞分析。包括健康献血者 PBMC 中受刺激和未受刺激的 B 细胞。
对每个样本中各个标志物的中位表达进行主成分分析 (PCA) 表明,使用前两个主成分,EBV(+) 和 EBV(−) B 淋巴瘤细胞系显著彼此分离,并与对照 B 细胞分离(图 5 A)。此外,将 EBV(+) 和 EBV(−) 淋巴瘤系映射到同一高维空间的均匀流形近似和投影 (UMAP) 图也显示两组之间同样显著的分离(图 5 B)。在 UMAP 空间内,可以识别出四个聚类。EBV(+) B 细胞系几乎构成了聚类A 和 B 的全部,而聚类 C 和 D 同样由 EBV(−) B 细胞系过度代表(图 5 C)。
值得注意的是,与 EBV(−) B 细胞系和对照 B 细胞相比,EBV(+) B 细胞系的特点是 CD23、CD95(Fas 受体)和 CD300a 表面表达显著较高(图 5 B-E),并且活化标志物 CD69 表达增加,与其活化表型一致。相反,与所有五种 EBV(+) 细胞系和对照 B 细胞相比,两种 EBV(−) 细胞系均表现出较低的 CD22 表达和显著较高的 CD24 表达(图 5 B-E)。此外,CD95、CD300A、CD22和CD24是转录水平上区分 EBV(+) 和 EBV(−) B 细胞系的 DEG 之一(图 2 B),与它们的蛋白质表达一致。
由于健康个体的 B 细胞由多个功能亚群组成,他们根据先前描述的 B 细胞表型表征方案将对照 B 细胞样本分为六个亚群。对所有细胞系和对照 B 细胞亚群按其中位标志物表达进行无监督层次聚类,将样本分成三个对应于其 EBV 和转化状态的聚类,所有实验组之间的表型标志物表达模式显著不同(图 5 F)。
他们通过分别缩放所有细胞系的中位标志物表达与对照 B 细胞亚群的标志物表达,解释了 EBV(+) 和 EBV(−) 细胞系与未转化 B 细胞的显著分离。将中位表达值缩放到相同的相对范围后,他们试图将每种 B 细胞系与其最接近的对照 B 细胞亚群联系起来。随后,他们进行了无监督的层次聚类。该分析显示,EBV(+) 细胞系 JB7 与幼稚 B 细胞最相似,而所有其他 EBV(+) 细胞系与各种 CD45RB+ CD27+记忆 B 细胞亚群更为相似。在 EBV(−) 细胞系中,Pfeiffer 与 CD45RB + CD27 −记忆 B 细胞亚群最相关,而 Toledo 与任何对照 B 细胞亚群均不相关(图 5G)。

图5. EBV(+) B 细胞系与 EBV(-) B 细胞系和健康 B 细胞具有不同的表面表型。
(A) PCA 分析。(B) 使用每个细胞系 3000 个细胞,使用所有 27 个选定标记绘制 UMAP 图。(C) EBV(+) 和 EBV(−) B 细胞系的聚类。(D) 所示表型标记表达的直方图,以反正弦变换的信号强度值表示。(E) EBV(+) 细胞系、EBV(−) 细胞系和对照 B 细胞之间指示表型标记的 CD300A中值信号强度比较。(F-G) B 细胞系和对照 B 细胞亚群中的B 细胞表型标记表达热图。
06
CD300A表达更高,是 EBV(+) PTLD B 淋巴瘤细胞最大程度增殖所必需的
应用综合多组学方法解决 EBV(+) 和 EBV(−) PTLD 之间的差异后,他们接下来评估了这种方法是否可以精确定位具有功能影响的分子。他们注意到CD300A转录本在原发性 EBV(+) PTLD 病变和 EBV(+) B 淋巴瘤系中一致上调(图2B)。在蛋白质水平上,CD300A 在 EBV(+) 和 EBV(−) 细胞系中同样过表达,而健康 B 细胞的 CD300a 表面表达可忽略不计(图5D-F)。由于CD300A在原发性 EBV(+) PTLD 病变和 EBV(+) B 淋巴瘤细胞系中均表现出表达增加,无论是转录本水平还是蛋白质水平,他们选择CD300A进行进一步研究(图 2F)。
他们首先评估了 EBV 是否能够引发 B 细胞中 CD300A 的表达,方法是评估健康供体的外周血 B 细胞和 EBV 介导的转化后的自体 B 细胞的表面 CD300A 水平。三种 EBV(+) 淋巴母细胞系 (LCL) 中的三种均由来自健康供体的外周 B 细胞由 EBV 感染而产生,与未感染的自体 B 细胞相比,CD300A 表达增加(图 6 A-B)。这些数据表明,人类 B 细胞的 EBV 感染和转化会诱导 CD300A 表达。
CD300A 是 CD300 多基因受体家族的成员,主要在免疫细胞外部表达。早期研究表明,CD300A 具有抑制功能,由其胞质尾内的四个免疫受体酪氨酸抑制基序 (ITIM) 介导。为了阐明 CD300A 在 B 细胞淋巴瘤中的作用,他们使用CRISPR-Cas9基因编辑从三种EBV (+) PTLD衍生的 B 细胞系(AB5、JB7 和 VB5)生成了CD300A敲除 (KO) 细胞系(图 6 C)。两种CD300A KO 细胞系(AB5 和 JB7)的KO 效率超过 85% ,而第三种 (VB5) 的 KO 效率为 40%-50%。他们首先评估了 CD300a 缺乏对这些细胞体外自发生长的影响。与相应的模拟编辑亲本细胞对照相比,所有三种CD300A KO EBV(+) B 淋巴瘤细胞系的扩增均显著减少(图 6 D)。此外,与模拟编辑的亲本细胞相比,所有三种CD300A KO EBV(+) 细胞系的晚期凋亡细胞(DAPI+、膜联蛋白 V+ 细胞)比例更高(图 6 E)。他们没有观察到任何细胞周期停滞的证据,也没有观察到整个细胞周期中细胞分布的显著差异。鉴于膜联蛋白 V 与磷脂酰丝氨酸结合,磷脂酰丝氨酸是 CD300A 仅有的两种已知配体之一,他们在亲本 EBV(+) 淋巴瘤系中对膜联蛋白 V+细胞的观察为存在能够与 CD300A 结合的生理配体提供了证据。总之,这些数据表明 CD300A 可能促进 EBV 转化的 B 细胞的生长和/或提供信号以阻止其凋亡。
为了进一步了解 CD300A 表达如何促进肿瘤生长,他们使用CD300A KO EBV(+) B 淋巴瘤系及其相应的模拟编辑对照的单细胞转录组分析 (scRNA-seq)表征了与CD300A耗竭相关的基因表达变化。使用所有三种 EBV(+) 细胞系的CD300A KO 和模拟编辑细胞之间的所有 DEG 进行 GO 通路过度表达分析,结果表明,在富含涉及呼吸和稳态代谢过程的通路的CD300A KO 细胞中 DEG 下调(图 6 F)。使用 GSEApy 包对 DEG 和京都基因与基因组百科全书 (KEGG) 通路分析进行的第二次独立评估也表明CD300A KO 细胞的代谢过程发生了改变,进一步表明 CD300A 可能参与调节与一般细胞呼吸有关的稳态信号,这可能导致CD300A缺失后观察到的生长减缓。

图6. CD300A 在 EBV(+) PTLD B 淋巴瘤细胞上表达更高,并且是其最佳生长所必需的。
(A-B) 健康供体的外周血 B 细胞和体外通过 EBV 转化的自体 LCL 中的 CD300A 表面表达。(C) EBV(+) PTLD B 细胞系中CRISPR-Cas9 介导的CD300A基因编辑示意图。(D) CD300A KO 细胞相对于 EBV(+) PTLD B 细胞系模拟编辑对照的体外生长情况。(E) CD300A KO 或模拟编辑 EBV(+) PTLD B 细胞系的凋亡分析。(F) 对CD300A KO中下调的基因通路过度表达进行分析。
07
CD300A 表达缺失导致体内EBV(+) B 细胞 PTLD 生长减少
为了评估 CD300A 缺陷是否影响体内淋巴瘤生长,他们使用了 EBV(+) PTLD 异种移植小鼠模型。免疫缺陷的非肥胖糖尿病-严重联合免疫缺陷 (NOD-SCID) 小鼠皮下注射来自 EBV(+) B 细胞系AB5或 JB7 的CD300A KO 或模拟编辑细胞。在肿瘤检测后 5-7 天内,与接受亲本模拟编辑细胞的小鼠相比,接受来自两种EBV(+) 细胞系的CD300A KO 细胞的小鼠的肿瘤生长显著受到抑制(图 7 A-B)。处死后,切除并收获肿瘤组织。CD300A KO 组的平均肿瘤体积显著小于模拟组,AB5和 JB7均小于模拟组(图 7 C-D)。
还对每组中 3 个代表性肿瘤进行了组织学和免疫组织化学分析。值得注意的是,CD300A KO 组的 Ki67 标记指数低于模拟组(图 7 E),AB5和 JB7的坏死率高于模拟组(图 7 F)。在所有肿瘤中均观察到强的膜性 CD20 染色和核 EBER ISH 信号,证实了它们的人类 B 细胞谱系和 EBV 阳性(图 7 E)。虽然可以在人类肿瘤异种移植中检测到小鼠单核细胞,但CD300A KO 或模拟编辑的 AB5 或 JB7 细胞衍生的肿瘤中单核细胞浸润频率没有显著差异,这与体外观察到的CD300A KO 和模拟编辑细胞之间高度相似的细胞因子/趋化因子分泌谱一致。总之,这些数据表明CD300A缺失会损害源自 EBV(+) B 细胞 PTLD 系的实体瘤的体内发育,从而提供了明确的证据,表明 CD300A 介导 EBV(+) B 细胞 PTLD 中的促肿瘤作用。

图7. CD300A 缺失导致 PTLD 异种移植小鼠模型中 EBV(+) B 细胞淋巴瘤生长减少。
(A-B) 注射了CD300A KO 或模拟编辑的 AB5或 JB7细胞的小鼠计算出的平均肿瘤体积。(C-D) 注射CD300A KO 或模拟编辑 AB5 或 JB7细胞的小鼠处死时的肿瘤体积。(E) 注射CD300A KO 或模拟编辑的 AB5 或 JB7 细胞的小鼠处死后采集的肿瘤组织学分析。(F) 注射CD300A KO 或模拟编辑的 AB5或 JB7细胞的小鼠处死时收获的肿瘤坏死评分。
+ + + + + + + + + + +
结 论
本研究揭示了 EBV(+) 和 EBV(−) PTLD 之间的核心差异,其特征分别是与免疫过程或 DNA 相互作用相关的基因表达增加,以及 EBV(+) PTLD B 细胞通过产生吸引单核细胞的细胞因子/趋化因子来调节肿瘤微环境的能力增强。本研究创建了一个蛋白质参考资源,用于区分 EBV(+) B 淋巴瘤细胞和 EBV(−) B 淋巴瘤,包括免疫调节分子 CD300A 和 CD24。此外,本研究还发现 CD300A 对 EBV(+) PTLD B 淋巴瘤细胞的最大存活率至关重要。本研究全面的多模态分析揭示了 PTLD 的生物学基础,并为精准治疗提供了机会。
+ + + + +



 English
English


