文献解读|Nat Commun(14.7):空间转录组学揭示三阴性乳腺癌中存在显著的异质性,具有潜在的临床意义
✦ +
+
论文ID
原名:Spatial transcriptomics reveals substantial heterogeneity in triple-negative breast cancer with potential clinical implications
译名:空间转录组学揭示三阴性乳腺癌中存在显著的异质性,具有潜在的临床意义
期刊:Nature Communications
影响因子:14.7
发表时间:2024.11.26
DOI号:10.1038/s41467-024-54145-w
背 景
三阴性乳腺癌 (TNBC) 占所有乳腺癌 (BC) 的 15-20%,预后不良。TNBC是一种异质性疾病,然而,对大量肿瘤进行的转录组分析 (RNA-seq) 技术存在重大缺陷,因为它无法捕获肿瘤内的地理异质性、不同肿瘤克隆之间的上位性相互作用或肿瘤微环境。因此,这种方法不足以全面剖析肿瘤生态系统的复杂性。
实验设计
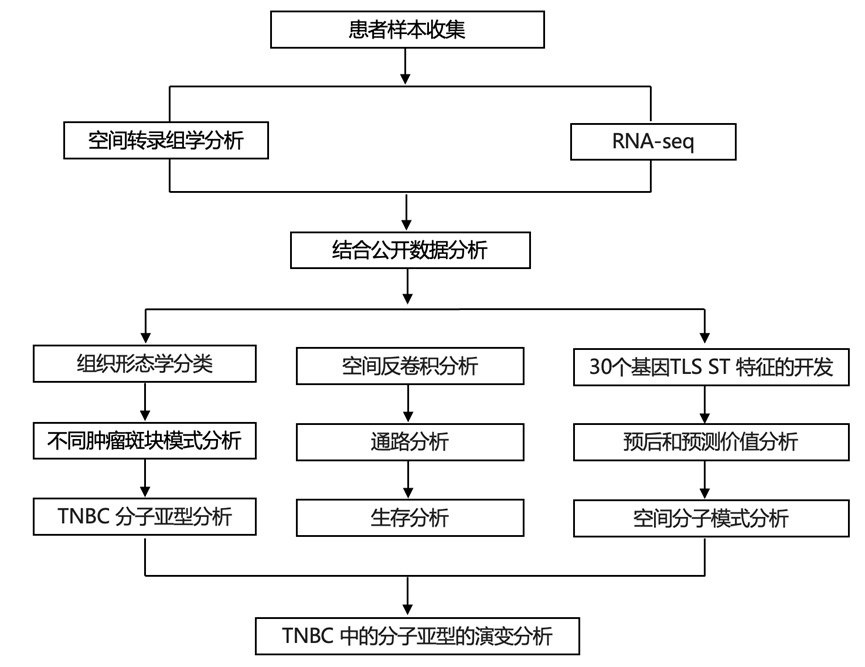
结 果
01
利用空间转录组学(ST)技术分析 TNBC 表达模式
之前对大量肿瘤进行的多组学分析已确定了几种 TNBC 分子亚型,即基底样( BL)、免疫调节 (IM)、管腔雄激素受体 (LAR)、间充质 (M) 和间充质干细胞样 (MSL)。这些分子亚型表现出不同的转录组、基因组和肿瘤微环境特征,并且与不同的临床结果和治疗反应的潜在差异相关(图1)。其中,IM 亚型以免疫基因特征和潜在可靶向的免疫检查点表达更高为特征,且与更好的预后相关。BL 亚型预后中等,以基因组不稳定性高、DNA 修复基因缺陷和TP53突变率高为特征。相反,M 和 MSL 肿瘤主要与血管生成和基质特征有关。最后,LAR 亚型以雄激素受体 (AR) 表达为特征,并富含PIK3CA、AKT1和CDH1突变,通常与较差的预后相关。此外,肿瘤微环境已成为 TNBC 预后和治疗反应的关键因素。肿瘤浸润淋巴细胞 (TIL)的定量水平、其空间组织和淋巴聚集体的形成均有望成为 TNBC 化疗和免疫治疗反应的预后和预测标志物。
为了全面研究 TNBC 特征性的肿瘤内异质性的形态学景观和转录组程序,研究团队对来自 94 例患者的 96 个原发性 TNBC 样本进行了 ST 分析(图 2)。特别地,他们使用了载玻片 ST 阵列含有 1934 个空间条形码点,每个点直径为 100 μm。每个点的转录谱由各种细胞类型的混合物组成,每个点最多 200 个细胞。在这项回顾性研究中,他们使用了从 Jules Bordet 研究所(比利时布鲁塞尔)组织库收集的新鲜冷冻手术标本。四个连续的冷冻切片中的三个用于 ST 分析,第四个切片用于双重免疫化学(IHC)染色,以辅助 TIL CD3+T 细胞和 CD20+B 细胞的组织形态学注释。额外的连续切片可用于进行RNA-seq,以便与 ST 结果进行相关分析。
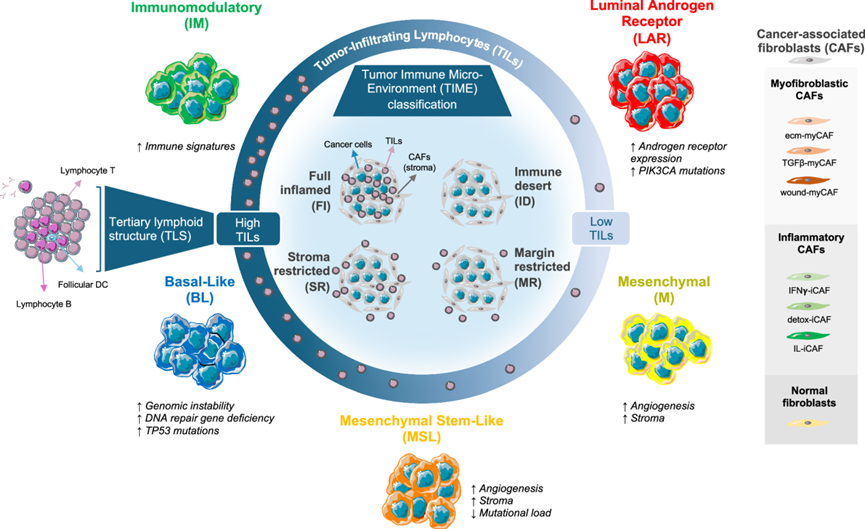
图1. 五种分子亚型。
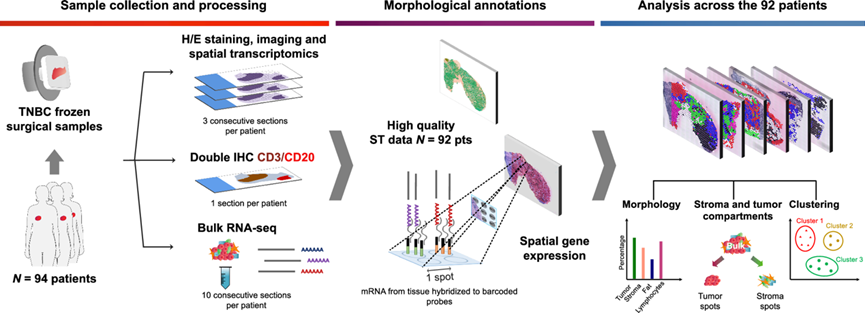
图2. 研究方案。
为了在形态学层面探索肿瘤内空间异质性,他们对 ST 切片的苏木精和伊红 (H/E) 染色切片进行了详细的手动注释。总共描绘了 15 个组织形态学类别,并进一步分为三大类:肿瘤(侵袭性和原位)、基质(脂肪组织、输乳管、血管、基质细胞和无细胞基质)和免疫特征(淋巴细胞和 TLS)。此外,他们根据肿瘤免疫微环境 (TIME) 分类17将每个样本分配到四个类别之一,从而研究了 TIL 的组织和定位:完全发炎 (FI)、基质限制 (SR)、边缘限制 (MR) 和免疫沙漠 (ID),TNBC 表现为高度异质性的实体(图3a-b)。
他们首先根据TNBC分子亚型查询了肿瘤样本的组织形态学组成,并观察到IM、BL和M亚型富含肿瘤内容,而LAR和MSL亚型富含基质成分(图 3c)。如预期的那样,淋巴细胞主要存在于免疫相关的IM亚型中,而LAR和MSL亚型表现出更高的正常结构患病率,包括脂肪组织和血管。接下来,他们旨在研究每个 TNBC 分子亚型中肿瘤和基质细胞的空间组织。为此,将相邻的单个肿瘤细胞分组并归类为肿瘤斑块,而将相邻的基质细胞/结构分组并归类为基质斑块。斑块进一步通过三个不同的指标来表征:它们的数量、平均大小和“均匀度”,即斑块大小多样性指数(图 3d)。BL 和 IM 亚型的特点是较大肿瘤斑块数量较少,多样性较高,而 LAR、M 和 MSL 亚型显示出更多数量的小而分散的肿瘤斑块(图3e),基质斑块在 TNBC 分子亚型中表现出相反的模式。
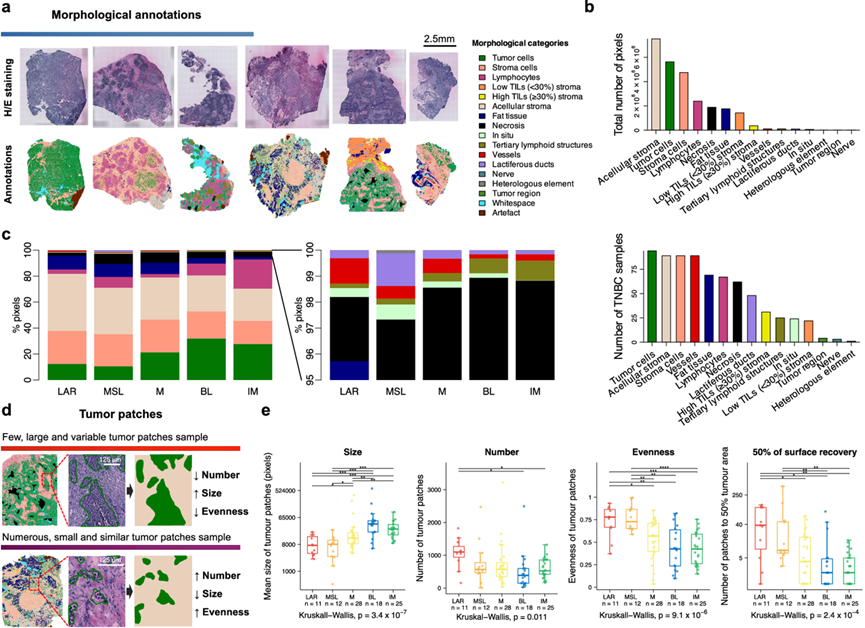
图3. 形态分析。
(a) 将每个 TNBC 样本的 ST 切片中的一张 H/E 染色载玻片的形态学注释分为十五个组织形态学类别。(b) 每个注释的组织形态学类别的总像素数(上)和包含不同类别的样本数(下)。(c)五种 TNBC 分子亚型中的形态学注释分布。(d) 以大小、数量和多样性指数(均匀性)为特征的不同肿瘤斑块模式的图示。(e) 按TNBC分子分类分布的肿瘤斑块指标。
02
不同 TNBC 分子亚型的空间反卷积显示肿瘤和基质区室的不同贡献
接下来,他们试图使用空间表达数据来研究肿瘤和非肿瘤(定义为“基质”)区室对 TNBC 分子分类的贡献。
为此,他们首先开发了回归量来估计每个 ST 点在基因表达水平的组成,鉴于先前描述的 15 种组织形态学类别,这些组织形态学类别分为总共 9 类:肿瘤、基质、坏死、脂肪组织、血管、输乳管、原位、TLS 和淋巴细胞。这些回归量准确地预测了大多数组织形态学类别。然后,他们设计了一种反卷积方法,用于从基因表达数据中估算每个形态学类别在单个点位上的分布情况,从而将形态学信息与ST数据联系起来。这使他们能够计算肿瘤和基质伪块(PB),它们分别是来自肿瘤和非肿瘤细胞的基因表达谱的数值近似值(图 4a)。值得注意的是,将基质区室定义为除肿瘤、原位和坏死类别外的所有类别的总和。
接下来,他们分别计算了肿瘤和基质 PB 上的 TNBC 分子亚型,以分析肿瘤或基质区室的哪些分子和细胞特征决定了 TNBC 分类。值得注意的是,他们进行了转录组分析(RNA-seq),对整个 ST 阵列的整体进行了验证分析(图 4a-b)。基于肿瘤区室的 TNBC 分类仅确定了三种亚型,即 LAR、M 和 BL,这表明由RNA-seq 定义的 IM 和 MSL 亚型依赖于基质特征(图4b)。IM 亚型由与肿瘤细胞或基质中接触的高水平浸润淋巴细胞的 BL 肿瘤定义,分别对应于 FI 和 SR TIME 类。MSL 亚型主要由与 MSL 基质相关的 M 肿瘤定义,而 M 亚型由与 M 或 MSL 基质相关的 M 肿瘤组成。最后,BL 亚型主要以具有 SR TIL 的基底肿瘤为特征,而 LAR 亚型则由 LAR 肿瘤组成,且 MR TIL 不存在或水平较低。值得注意的是,少数归类为肿瘤区室中的 IM和基质区室中的 BL的样本可能是人为的,并且由于反卷积方法无法分别区分每个区室中免疫细胞和肿瘤细胞的污染(图 4b)。这些结果表明肿瘤和基质区室对于 TNBC 分类都至关重要,并强调了无法通过RNA-seq技术捕获的 TNBC 亚型异质性程度。
然后,他们研究了 TNBC 分类中每个肿瘤和基质区室的特征生物学过程。当关注肿瘤区室时,M 肿瘤与高上皮间质转化 (EMT) 信号传导以及 PDGFRA 和 NTRK2 基因表达相关。LAR 肿瘤富含代谢和 PI3K/AKT/mTOR 信号传导,而 BL 肿瘤显示出更高的增殖和 DNA 修复标志(图 4c)。对基质区室进行的类似分析显示, MSL 基质显示出更高的血管生成和癌症相关成纤维细胞 (CAF) 信号,而 M 基质与更高的中性粒细胞浸润和更低的免疫信号相关,这与 M 基质表现出 ID TIME 表型一致。 LAR 基质表现出更高的脂肪生成,而 IM 基质则以几种免疫特征的更高水平为特征,包括 TLS、组织驻留记忆细胞 (Trm) 和干扰素γ信号通路炎症CAF (IFNγ-iCAF) 特征(图 4c)。
接下来,他们评估了给定样本中不同分子亚型的肿瘤和基质成分的组合是否对临床结果有影响。如前所述,M 亚型可以源自与 M 基质或 MSL 基质的关联(图 4b-d)。有趣的是,当基质为 MSL 且富含免疫激活信号[包括两种炎症 CAF,即 IFNγ-iCAF 和白细胞介素途径炎症 CAF(IL-iCAF)]时,分配为 M 亚型的患者比基质为 M 时具有更好的远端复发生存期 (DRFS)(图 4e-f)。MSL 和 M 基质主要分别与 MR 和 ID 免疫表型相关(图 4b)。这些结果表明,每种 TNBC 分子亚型内的患者体内都存在很大的异质性,肿瘤和基质特征的不同贡献与不同的分子特征和临床结果有关。

图4. TNBC 分子亚型的空间反卷积。
(a) 三个的基因表达数据。(b) 冲积图显示来自ST 整体、肿瘤和基质假块的 TNBC 亚型的分布,以及空间免疫表型(TIME 分类)。(c) 跨 TNBC 亚型的肿瘤(上)和基质(下)区室的分子和细胞表征 。(d) 与 M(左)或 MSL(右)基质相关的 M 亚型的示例。(e) 表征具有 M(左)或 MSL(右)基质的 M 亚型的分子和细胞特征热图。(f) 生存分析。
03
TLS 的特征及其与免疫治疗反应的关系
TLS 是异位淋巴器官,已证明与良好的预后和对治疗(包括免疫治疗)的反应有关,它可以更好地将肿瘤抗原呈递给 T 细胞,从而增强特异性抗肿瘤反应。目前,对于从 H/E 或 IHC 染色的组织切片中检测 TLS 尚无共识。此外,TLS 的基因表达很难获得,因为它们是由不同细胞组成的小聚集体,可能与 TIL 或非 TLS 免疫聚集体相同。通过对 ST 基因表达数据进行反卷积来得出特定于 TLS 区室的基因表达谱。先前开发的回归量估计的 TLS 投影与组织和形态学定义的 TLS 共定位,证明了回归量根据基因表达数据预测 TLS 的可靠性(图5a)。
然后,他们研究了 TLS 组成与非组织淋巴细胞区室的区别。正如预期的那样,TLS 在所有 B 细胞亚群、CD4+(中枢)记忆和幼稚 T 细胞以及肥大细胞中富集(图 5b)。功能富集分析显示,与单个淋巴细胞相比,TLS 中“有丝分裂 G2/M 转换检查点”、“血管内皮细胞增殖”、“V/D/J 重组”和“细胞对成纤维细胞生长因子的趋化调节”发生激活,这表明 TLS 的形成可能与免疫细胞增殖、血管生成、适应性体液反应和组织重塑有关(图 5c)。
然后,他们旨在通过比较 TLS 与淋巴细胞区室以及 TLS 与其他非免疫相关区室的基因表达数据来开发特定的 TLS 特征(图 5d)。这导致了 30个基因 TLS ST 特征模型的开发,其中包括 11 个 B 细胞特异性基因(CD79A、CD79B、TNFRSF13C、BLK、CD22、CD37、MS4A1、NIBAN3、CD19、IKZF3、LINC00926)、6 个 TLS 引发基因(CXCR5、LTB、SELL、CCL19、POU2AF1、CXCL13)、4 个免疫球蛋白基因(FCRLA、VPREB3、FCMR、AL928768.3)、3 个 T 细胞特异性基因(RASGRP2、TCF7、RIPOR2)、4 个免疫反应相关基因(RAC2、IL16、CCR7、CD52)以及TCL1A和ATP2A3基因。正如预期的那样,特征基因与之前报道的 TLS 特征基因存在重叠,从而增强了本研究 ST 方法的可靠性。他们进一步比较了 TLS ST 30个基因特征与其他 TLS 特征在区分 TLS 与九种组织病理学类别[特别是 TIL(以淋巴细胞区为代表)]方面的性能,并表明TLS 特征对 TLS 区具有最高的特异性。
此外,TLS ST 特征在 ST 载玻片上的投影与病理学家注释为 TLS 的区域准确重叠(图 5a-e)。对 TLS 预测的高精度通过曲线下面积 (AUC) 定量评估。即使与其他 TLS 特征相比,它也表现出对 TLS 检测的高特异性。正如预期的那样,在 IM 亚型和 FI 肿瘤中观察到最高水平的 TLS 特征,而在 M 亚型和 ID 肿瘤中观察到最低水平(图 5f-g)。

图5. 三级淋巴结构的空间特征和 30个基因 TLS ST 特征的开发。
(a) 通过 CD3/CD20 IHC 染色展示 TLS 检测的说明性样本(ST_TNBC_ID 30),以及 H/E 染色的 ST 载玻片的形态学注释(以卡其色突出显示)和相应的形态学回归。(b) 与ST TNBC 队列中的淋巴细胞区室相比,TLS 中xCell的细胞类型富集。(c) 与 ST TNBC 队列中的淋巴细胞区室相比,TLS 中由 GO:BP 确定的选定富集生物学通路。(d) 散点图显示 TLS 与淋巴细胞(x 轴)或其他非淋巴细胞区室(y轴)比较所得的 30 个差异表达基因,构成 ST TNBC 队列中的 TLS ST 特征。(e) TLS ST 特征表达在同一 TNBC 样本 (ST_TNBC_ID 30) 上的投影。(f-g) ST TNBC 队列中 TNBC 分子亚型和 TIME 分类之间的 TLS ST特征表达分布。
04
30个基因 TLS ST 特征的预后和预测价值
接下来,他们使用ST 队列、公开的 BC 数据集[国际乳腺癌联盟分子分类学 (METABRIC)、SCAN-B 41和 I-SPY2 ]以及接受免疫疗法治疗的转移性非乳腺肿瘤数据集,评估了 TLS ST 特征对临床结果和免疫疗法反应的预测价值。在ST 队列和外部 METABRIC 和 SCAN-B TNBC 队列中,TLS ST 特征表达水平高的患者预后良好(图6a)。值得注意的是,在 I-SPY2 研究中,TLS ST 特征水平较高与病理完全缓解 (pCR) 率较高相关,主要是在接受免疫疗法治疗的早期 TNBC 患者中(图 6b)。在接受免疫疗法治疗的非 BC 队列(包括转移性黑色素瘤、胰腺癌和膀胱癌)中也发现了类似的结果,其中 TLS ST 特征在预测临床结果方面优于其他基因特征(图 6c-d)。这表明 TLS 在获得肿瘤区域附近可持续的适应性抗肿瘤免疫反应方面发挥着关键作用。
最后,他们评估了TLS ST 特征是否独立于先前报告的免疫特征预测了对免疫疗法的反应。在调整了各种免疫特征(包括其他 TLS 特征)后,TLS 特征保留了其对免疫疗法反应的预测能力(图6e)。相反,在调整TLS ST 特征后,几种免疫特征的预测效果降低了(图 6f)。
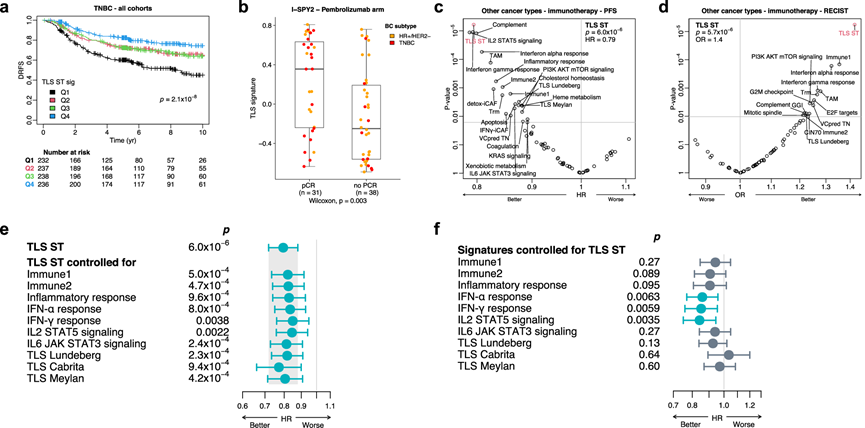
图6. TLS ST 特征的预后和预测价值。
(a) Kaplan-Meier 图。(b) 患者的 pCR 状态的 TLS ST 特征水平。(c-d) 使用 TLS ST 特征和其他已报告的特征预测接受免疫检查点抑制剂治疗的转移性非乳腺癌的 PFS和放射学反应 (RECIST)。(e) TLS ST 特征与 PFS 的关联。(f) 在调整同一队列中的 TLS ST 特征后,不同免疫特征与 PFS 的关联。
05
鉴定三阴性乳腺癌患者共有的 14 种空间分子模式
为了进一步评估肿瘤内空间异质性,他们根据 ST 表达数据对每个样本的斑点进行了无监督 K 均值聚类,从而识别出空间分子模式(图 7a)。该分析显示 94 个 TNBC 样本中有 418 个聚类(每个样本 2-8 个聚类),每个聚类对应一组具有相似基因表达模式的斑点(图 7b)。
为了根据 TNBC 分类研究肿瘤内异质性,他们首先将每个单独的聚类分配给特定的分子亚型。大多数 TNBC 样本包含两到三种不同分子亚型的聚类(图7c),94 个肿瘤样本中只有 16 个仅由与整体 PB 相同亚型的聚类组成。其中一半属于具有 FI 免疫表型的 IM 亚型(N = 9/16)。大多数 BL 亚型包含一个或两个对应于 SR 免疫表型的 IM 聚类(N = 11/13),而 75% 的 M 亚型包括分别与 SR 或 ID 免疫表型相关的 M 和 MSL聚类( 每个类N = 8/21)。同样,许多 LAR 肿瘤包含具有 ID 免疫表型的 MSL聚类(N = 5/9)。这些数据揭示了超出 TNBC 分类的患者内异质性程度及其与 TIL 定位的关联。
接下来,他们通过使用 K 均值算法揭示了 14 个超聚类 (MC),它们重现了 TNBC 特有的空间基因表达异质性(图 7 a-d)。MC 1、2、3、5 和 6 的特点是肿瘤含量高、增殖率高和免疫信号低,而 MC 7、9、10、14 则与几种免疫特征的高水平相关。MC 9 显示出最高水平的 TLS 特征(“TLS ST”),表明与 MC 11、12 和 13 相比有组织的免疫反应,显示出与免疫抑制一致的特征,包括基质激活。MC 11 和 14 中CD73基因的高表达表明腺苷途径发生激活。此外,MC 14 表现出先天免疫细胞的浸润,其中树突状细胞 (DC)、单核细胞和巨噬细胞含量较高。总体而言,MC 13 和 14 在脂肪细胞中广泛富集(图7d)。
有趣的是,MC 1 至 6 的特点是 DNA 修复特征高表达,其中 MC 1 显示同源重组修复和错配修复基因的最高表达以及几种去甲基化酶的高表达(图 7d)。MC 1 最有可能由极化的 Th2 细胞浸润,而 MC 2 则富含促肿瘤发生的中性粒细胞。此外,MC 2 表达更高水平的CD47基因,该基因在维持中性粒细胞方面发挥作用,与中性粒细胞凋亡的延迟有关。 MC 5-6 主要见于 IM 和 BL 亚型,表现出较高的 mTORC1 和 PI3K/AKT/mTOR 信号传导,而 MC 11 和 MC 14 见于 M 和 MSL 亚型,表现出较高的血管生成和 EMT 水平。MC 8 是 LAR 亚型所特有的,表现出最高的AR基因表达以及几种捕获代谢和脂肪生成的特征的高表达(图 7d)。
他们最终评估了单个 MC 是否可以预测临床结果。为此,他们通过点级别的反卷积重新估计了 MC 贡献,然后执行单变量和多变量(根据临床病理特征调整)生存分析。MC 5 与更好的结果相关,而 MC 2 和 MC 12 则显示出较差的生存趋势(图7e)。他们开发了一种反卷积方法来评估来自大量基因表达数据的每个 MC 的存在。有趣的是,在结合 METABRIC 和 SCAN-B 数据集的大型队列中,所有 MC 与临床结果之间的关联显示出一致的趋势(图 7f)。此外,在这个广泛的数据集中,生存分析确定了一个额外的 MC,特别是 MC 9,它显示出与更好的结果相关的趋势,并以有组织的免疫反应为特征(图 7f)。

图7. 空间分子模式的特征。
(a) 概述了表征 TNBC 样本间共有的空间分子模式的 3 步方法,从而鉴定出 14 个超聚类和 9 个空间原型。(b) 在代表性 BL 亚型 TNBC 样本(ST_TNBC_ID 30)中患者内(顶部)和患者间(底部)聚类的投影。(c) 基于TNBC 分子分类的患者内聚类的异质性。(d) TNBC 患者间共有的 14 个聚类的形态学、分子和细胞特征。(e-f) 反卷积分析。
06
九个空间原型(SA)重现了具有潜在临床意义的 TNBC 生态系统
在这里,他们通过评估样本内是否存在特定的 MC 以及共存比例来研究 TNBC 生态系统。根据 MC 比例进行层次聚类,发现有 9 个 TNBC SA,每个 SA 由 14 种 MC 的组合决定(图 8a-b)。每个 TNBC 样本分配到 9 个 SA 中的一个。虽然根据 TNBC 分子分类,一些 SA 更加异质,但其他 SA 则更特定于某一亚型。IM 肿瘤在 SA 4 中富集,而 LAR 肿瘤则仅由 SA 5 代表(图8c)。
然后,他们研究了表征每个 SA 的分子和细胞过程。SA 1 至 SA 4 主要表现出 FI 和 SR 免疫表型,而 SA 5 至 SA 9 显示 MR 和 ID 免疫表型(图 8a)。SA 1、SA 3 和 SA 4 表现出免疫信号富集。值得注意的是,SA 4 显示出有组织的免疫反应,其特征是高水平的三级淋巴结构(“TLS ST”特征)和 IFNγ-iCAF 浸润,加上低基质活化和低 EMT(图 8d-e)。这些观察结果共同表明是一种高度免疫原性的 SA。此外,细胞类型富集分析显示,SA 4 在 B 细胞、浆细胞、CD8+中枢记忆和幼稚 T 细胞、巨噬细胞和树突状细胞 (DC) 中富集。
作为一项探索性分析,他们还探究了 SA 是否通过特定基因的表达或通路失调表现出治疗脆弱性。有趣的是,SA 1 和 SA 4 显示出更高的“VCpredTN”特征表达,此前该特征与对 PARP 抑制剂的反应有关(图8e)。SA 2 与编码 Trop-2 和 HER3 蛋白的TACSTD2和ERBB3基因的更高表达相关,其中 Trop-2 可通过抗 Trop-2 抗体-药物偶联物 (ADC) 靶向,而 HER3 称为人类表皮生长因子 (EGFR/HER) 受体酪氨酸激酶家族的成员,可通过抗 HER3 疗法靶向(图8e-f)。SA 3 和 SA 4 显示 PD-L1 表达富集,这与免疫浸润整体相关(图 8f)。SA 7 以高免疫抑制“腺苷”通路(CD73基因)为特征,而SA 8 显示高NECTIN4表达,编码 Nectin-4,其是特定 ADC的靶点(图 8e-f)。此外,LAR 特异性 SA 5 显示相对较高的ERBB2基因表达和几种代谢相关通路的激活,表明对抗 HER2 和抗代谢药物敏感(图 8e-f)。
生存分析显示,SA 4 肿瘤患者的生存率最高,而 SA 8 肿瘤患者的预后最差(图 8g-h)。有趣的是,在 SA 4 组中,与其他 SA 的 IM 肿瘤患者相比,IM 肿瘤患者的预后趋于更有利(图 8h)。这一观察结果强调了 IM 亚型固有的显著异质性。这些结果表明,ST 分析揭示了超越 TNBC 分类的 TNBC 生态系统的复杂性,并鉴定了临床相关的 SA,其中一些与生存相关,可视为潜在的治疗靶点(图 9)。

图8. 九种空间原型的分子和细胞特征及其与生存的关联。
(a) 通过对 14 个巨聚类进行层次聚类来识别 9 个 SA。(b) ST TNBC 队列中每个 SA 内 14 个巨聚类的比例。(c) 合并的 TNBC 队列中SA 之间的 TNBC 分子亚型分布。(d) ST TNBC 队列中 SA 之间的 30个基因 TLS ST 特征分布。(e) 基于基因特征、细胞类型富集和单基因分析,对 ST TNBC 队列中的 SA 进行分子和细胞表征。(f) 合并 TNBC 队列中SA 之间五个可靶向基因的表达。(g) 合并 TNBC 队列中SA 与 iBCFS 之间的关联。(h) Kaplan -Meier 图显示合并 TNBC 队列中 SA4、SA4 中的 IM、非 SA4 中的 IM 和 SA8 的 iBCFS 。
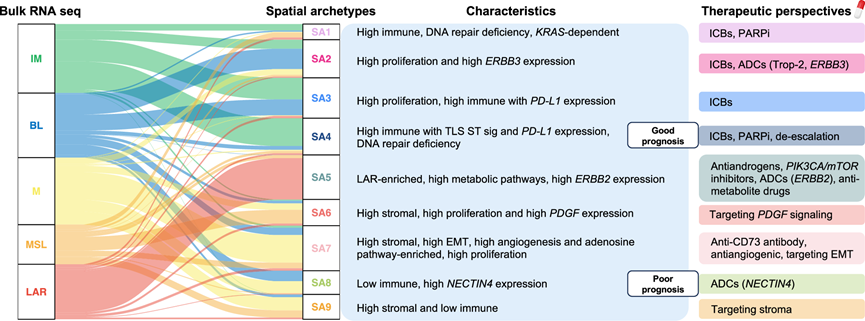
图9. TNBC 中的分子亚型的演变。
+ + + + + + + + + + +
结 论
本研究使用空间转录组学对 92 名患者研究了 TNBC 肿瘤结构及其微环境,结合组织形态学和空间转录组学的综合方法对肿瘤和基质组织和组成进行了深入表征。此外,对三级淋巴结构的详细分子表征导致在 TNBC 以外的几种肿瘤类型中识别出与疾病结果和对免疫疗法的反应密切相关的基因特征。逐步聚类分析确定了九种 TNBC 空间原型,并在外部数据集中进一步验证。几种空间原型与疾病结果相关,并具有潜在可操作的特征。在这项工作中,本研究全面了解了具有潜在临床相关性的 TNBC 生态系统的复杂性,为包括免疫疗法在内的治疗定制开辟了途径。
+ + + + +



 English
English


