文献解读|Aging Cell(8.0):解读从儿童到衰老时期的免疫衰老:转录变化、炎症动力学和适应性免疫改变
✦ +
+
论文ID
原名:Deciphering Immunosenescence From Child to Frailty: Transcriptional Changes, Inflammation Dynamics, and Adaptive Immune Alterations
译名:解读从儿童到衰老时期的免疫衰老:转录变化、炎症动力学和适应性免疫改变
期刊:Aging Cell
影响因子:8.0
发表时间:2025.04.26
DOI号:10.1111/acel.70082
背 景
免疫系统对于抵御病原体和维持体内平衡至关重要,它会随着年龄增长而发生改变,称为免疫衰老。免疫衰老过程涉及免疫器官的结构改变以及先天性和适应性免疫功能障碍,导致对感染和疫苗的应答降低,并增加患慢性疾病和肿瘤的风险。了解免疫衰老的机制对于应对衰老挑战和改善老年人健康状况至关重要,外周血单核细胞 (PBMC) 能够便捷全面地反映人体的免疫状态。
实验设计
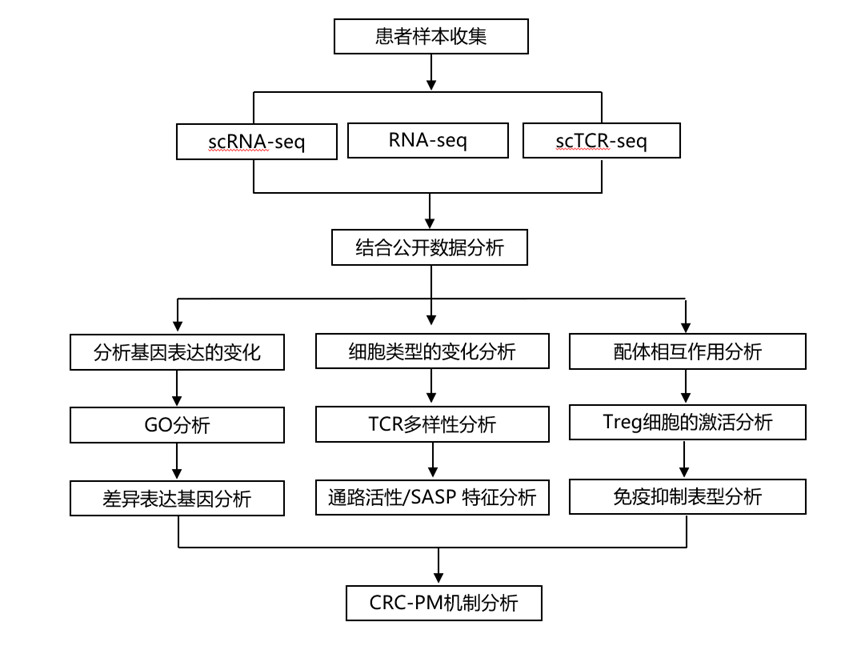
结 果
01
健康衰老过程中PBMC转录组的动态变化
研究团队整合了 181 名健康个体的 PBMC的转录组分析(RNA-seq)数据,创建了一个年龄跨度从 1 岁到 99 岁的综合队列。采用线性模型,探索了与年龄相关的基因表达变化。结果发现 769 个基因随年龄增长而上调,包括PTGDS和GZMH,2624 个基因随年龄增长而下调,包括CR2和CD248(图 1A)。GO和KEGG通路富集分析显示,随着年龄增长,淋巴细胞特征下降,通路下调,例如“B细胞受体信号通路”、“免疫球蛋白生成”和“T细胞受体复合物”(图 1B)。相反,与细胞因子和细胞毒性相关的通路则随着年龄增长而上调,例如“细胞因子受体相互作用”和“细胞杀伤”(图 1B)。为了了解人类衰老过程中的转录组趋势,他们将 LOESS 平滑应用于基因表达与年龄的关系。层次聚类确定了不同的年龄相关基因表达模式:特别是聚类4(TLR2、PTGDS、MMP9、IL18、CX3CR1、GZMB、GNLY等)和聚类 6(CD79A、CD19、TCL1A、CD27、SOX4、TCF7、LEF1、CCR7等)表现出明显的年龄相关改善或下降,并且分别在细胞毒性、炎症、髓系细胞特征和淋巴细胞特征中富集(图 1C-E)。值得注意的是,这些表达模式在早期生命中经历了快速变化,在健康老年组中逐渐减慢并趋于稳定。此外,通过差异表达—滑动窗口分析(DE-SWAN),他们确定了 21、40 和 89 岁时的基因表达差异峰,每个峰都与独特的转录组模式相关(图 1F-G)。在 21 岁时,上调的基因富集于炎症和髓细胞功能,而下调的基因与 B 细胞和浆细胞功能有关。在 40 岁时,包括LEF1和CD248在内的下调基因因“解剖结构回归”而富集,与之前报道的负面衰老效应一致。有趣的是,21 岁和 40 岁时特定上调或下调的基因在 89 岁时趋于稳定,并且仅在高龄个体中发现核糖体基因上调。
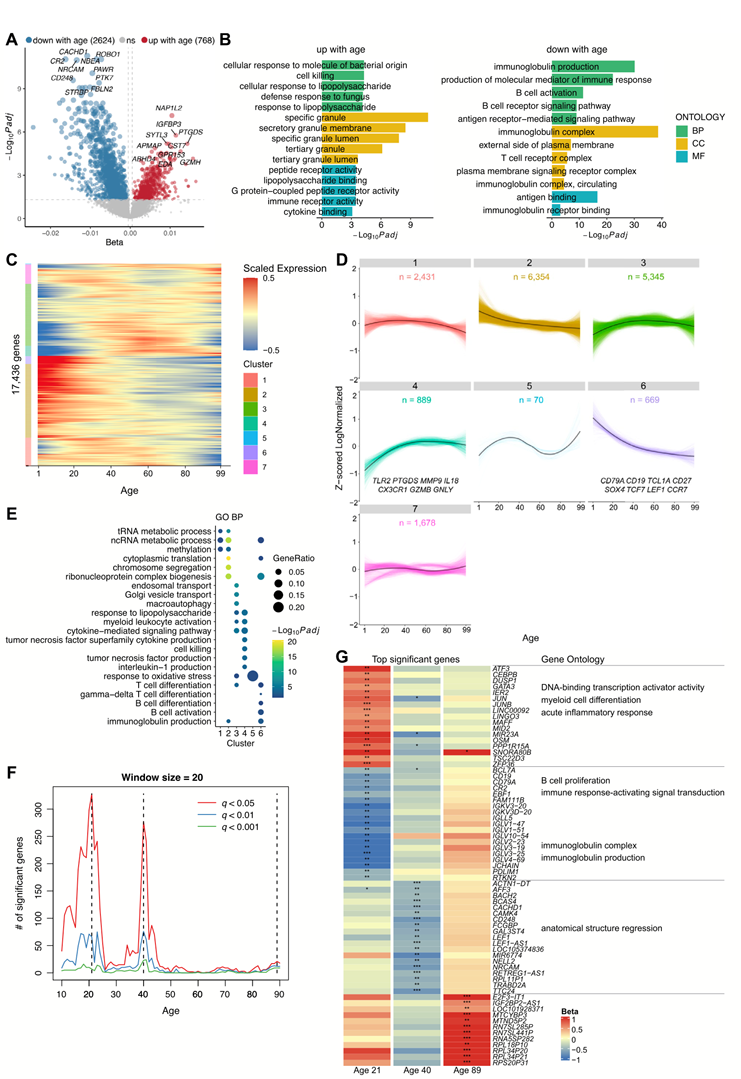
图1. PBMC 转录组的年龄相关变化。
(A) 火山图显示 PBMC 基因表达随年龄的变化。(B)GO分析。(C) 由 LOESS得到的基因表达轨迹随年龄变化的热图。无监督层次聚类将具有相似轨迹的基因分为七个聚类。(D) 折线图显示了基因表达轨迹随年龄的变化,并根据无监督层次聚类划分为聚类。(E)GO分析。(F) 折线图显示随年龄变化的差异表达基因数量。(G)差异表达基因和通路分析。
02
PBMC 组成和 TCR 库随年龄的动态变化
他们整合了 47 位年龄从 1 岁到 100 岁健康个体的单细胞转录组分析(scRNA-seq) 数据,创建了超过 360000 个单细胞的 PBMC图谱(图 2A)。根据各自的标记基因定义了六种主要细胞类型。经过 SCALEX 处理后,scRNA-seq 数据没有显示出明显的批次效应。此外,根据各自的标记基因进一步定义了 32 种不同的细胞亚型(不包括双联体聚类)(图 2A)。与衰老相关的细胞类型包括记忆 T 细胞亚群(CD8_Tem、CD4_Tm、CD4_Tm-IL7R)和细胞毒性 T 淋巴细胞(CTL)亚群 CD8_CTL,它们与年龄呈正相关。相反,CD8_Naive、浆细胞、pDC和B细胞亚群的丰度与年龄呈负相关(图 2B-D)。值得注意的是,浆细胞和CD8_Naive细胞的数量与年龄呈最强的负相关,尤其是在1至60岁年龄段,在健康衰老后期保持稳定,这与在大量细胞转录组中观察到的动态一致(图 2C)。
单细胞T细胞受体测序(scTCR-seq)中,CD8_Tem(CD8+效应记忆T细胞)和CD8_CTL细胞表现出明显的克隆扩增,且具有最高的功能转换潜能。此外,除CD4_Treg(CD4+调节性T细胞)和CD8_MALAT1(MALAT1高CD8+ T细胞)细胞外,大多数T细胞亚型在60岁以后均表现出TCR多样性降低(即克隆扩增和基尼系数增加)(图 2H-I),这与报道的65岁左右的衰老拐点相呼应。
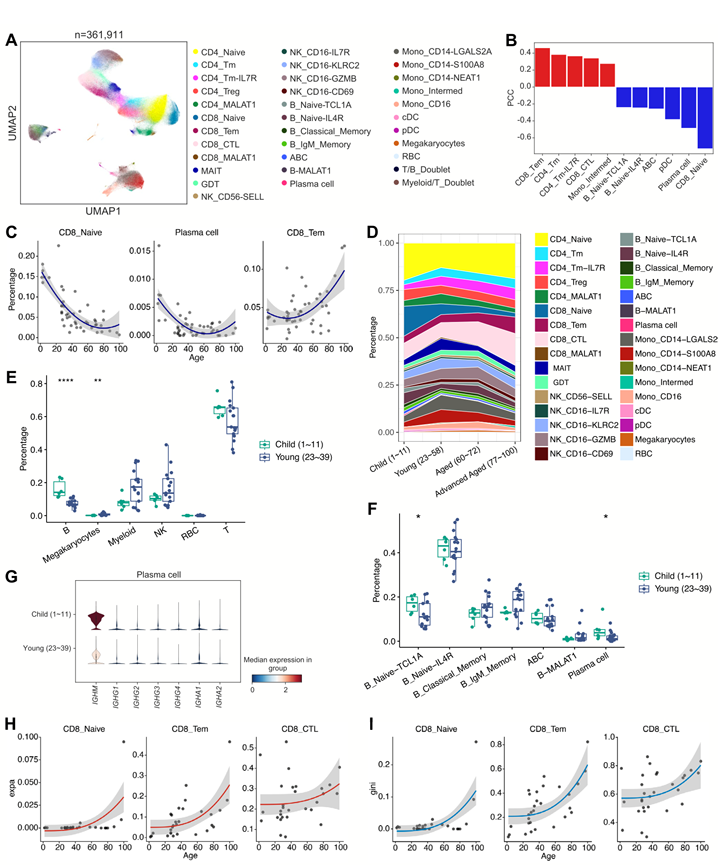
图2. 通过 scRNA-seq 和 scTCR-seq 研究 PBMC 中的年龄相关变化。
(A)PBMC 单细胞聚类的 UMAP(均匀流形近似和投影)可视化。不同的细胞类型用不同的颜色表示。(B)根据健康个体 PBMC scRNA-seq 数据,细胞类型比例随年龄变化的 PCC。仅显示 PCC 绝对值 > 0.2 的细胞类型。(C)PBMC 中细胞类型比例(y轴)与个体年龄(x轴)的散点图。(D)各定义细胞类型比例随年龄组的变化。(E)用于比较儿童和青少年样本组之间主要细胞类型比例的箱线图。 (F)儿童与青少年样本组B细胞亚型比例比较箱线图。(G)小提琴图显示儿童与青少年样本组浆细胞免疫球蛋白相关基因表达水平。(H)选定T细胞亚型的TCR克隆扩增(y轴)与年龄(x轴)的散点图。(I)与(H)相同,但用于TCR组库与年龄的基尼系数。
03
虚弱型外周血 (PB) 的炎症反应增强
为了进一步探索不健康衰老导致的外周免疫细胞的变化,他们将 PBMC 图谱投射到虚弱(病理性衰老状态)的老年个体上,并将其与健康的高龄个体的数据进行比较(图 3A)。虚弱导致 CD8_Naive 细胞显著减少,Mono_CD14-S100A8(CD14+ S100A8高表达单核细胞)和 B_Naive-IL4R 细胞显著增加(图 3B)。因此,他们继续研究健康和虚弱老年个体(虚弱组)之间这些细胞亚群的功能变化。与健康老年人相比,虚弱组的 B_Naive-IL4R 细胞中应激诱导的 MAPK 级联和 NF-κB 信号通路富集。此外,虚弱个体的CD8_Naive细胞T细胞衰老和效应T细胞相关基因(例如KLRG1和GZMK)上调,而CCR7、IL7R、GPR183和CXCR4下调。与健康老年人相比,这些细胞在与细胞凋亡、DNA损伤、NF-κB信号传导和TNF应答相关的通路中也表现出活性增强。通过流式细胞分析,在另一个样本队列中的衰老个体中观察到 幼稚CD8 + T细胞(CD45RA + CD62L + CD8 +)比例的类似下降。
此外,Mono_CD14-S100A8 细胞在健康衰老过程中表现出稳态基因表达下降和炎症因子表达逐渐增加(例如TNF、IL1B和CXCL8)(图 3C)。然而,在体弱的老年个体中,这些细胞表现出炎症因子的快速上调,并且单核细胞普遍表现出显著更高的 SASP 功能评分,表明其具有显著的 SASP 特征。在体弱个体中,Mono_CD14-S100A8 细胞还富集了与脂多糖和 TNF 反应以及 NF-κB 信号传导相关的通路活性(图 3D)。此外,细胞间通讯分析显示,PBMC中的炎症相关信号通路(TNF、IL1、IL6 和 CXCL)主要由单核细胞亚群驱动(图 3E),与健康老年个体相比,体弱老年个体的单核细胞亚群输出增加(图 3F)。为了评估 PB 中的炎症激活水平和细胞因子浓度,他们通过 ELISA 分析了另一队列中 CRP、TNF-α、IL-1β 和 IL-6 蛋白的表达。同样,与健康老年人相比,体弱个体的这些蛋白质水平显著升高(图 3G)。有趣的是,抗炎基因ANXA1 的mRNA 表达随年龄增长而增加(图 3H),而在 75 岁及以上健康个体的RNA-seq数据中,与ANXA1具有 PCC 大于 0.7 的基因在相关通路中富集,例如白细胞细胞间粘附(图 3I)。然而,与健康老年人相比,体弱人群的血浆Anxa1蛋白水平显著降低(图 3J)。细胞通讯分析中其信号输出也明显降低(图 3K)。这些发现可能表明ANXA1在健康衰老和体弱过程中的抗炎过程中发挥作用。
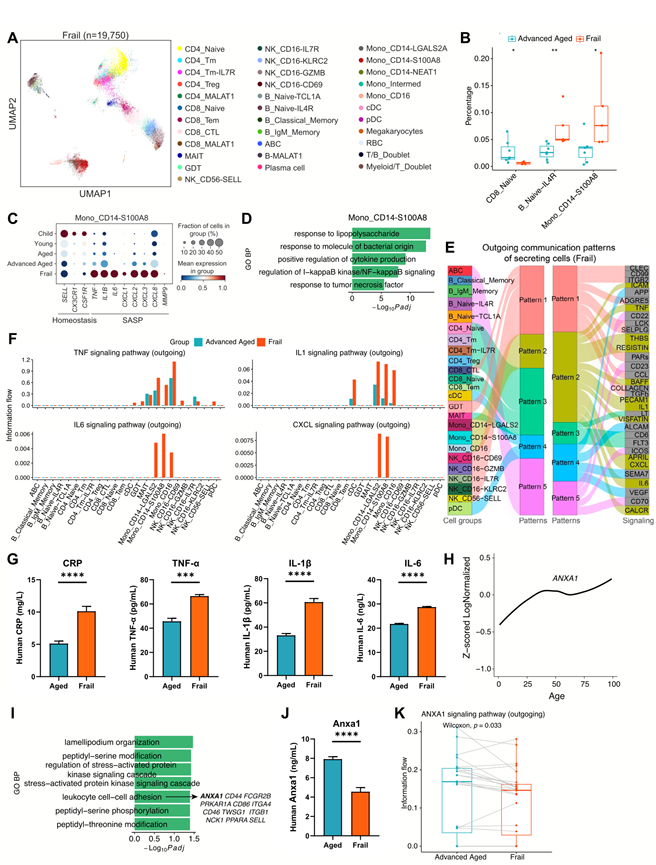
图3. 体弱老年人外周血(PB)炎症反应增强。
(A)体弱个体外周血单核细胞(PBMC)的scRNA-seq 数据的UMAP 可视化。不同细胞类型用不同颜色表示。(B)用于比较体弱和健康老年个体中特定细胞类型比例的箱线图。(C)点图显示不同年龄组 Mono_CD14-S100A8 细胞中特定基因的表达情况。(D)与健康老年个体相比,体弱个体的 Mono_CD14-S100A8 细胞中上调基因的 GO 生物过程显著富集。(E) 推断的衰老的分泌细胞的传出通讯模式,显示了推断的潜在模式与细胞群以及信号通路之间的对应关系。(F) 条形图显示高龄和衰老供体每种细胞类型的TNF、IL1、IL6和CXCL信号通路的传出信息流。(G) 供体的血浆CRP、TNF-α、IL-1β和IL6蛋白水平。(H) 折线图显示ANXA1表达随年龄的变化轨迹。 (I) 75岁及以上捐献者的RNA-seq样本中,与ANXA1正相关(PCC > 0.7)基因的显著富集。图中显示了在白细胞间粘附中富集的基因。(J) 与(G)相同,但针对的是Anxa1蛋白。(K) 箱线图比较了老年和体弱老年人各细胞类型ANXA1信号通路的信息流。每个配对点对应两个样本组中相同细胞类型的两个细胞群。
04
衰老状态下的克隆扩增和效应Treg细胞
他们观察到衰老个体的 CD4_Treg 细胞 TCR 克隆扩增增加,效应 Treg (eTreg) 相关基因(如ICOS、BATF和PRDM1 )表达上调,与健康老年人相比,这些 CD4_Treg 细胞在 T 细胞活化和 TNF 介导的信号通路中表达富集(图 4A-C)。然而,随着健康老龄化发生,除了TGFB1表达上调外,CD4_Treg 细胞的效应相关基因并未明显升高,这与 CD4_Treg 细胞 TCR 多样性没有随年龄发生明显变化相一致(图 4B)。流式细胞分析显示,衰老个体的 eTreg(CD25 + CD278 + CD4 + T)细胞比例也有所升高(图 4D-E)。对衰老的进一步研究表明,支持 eTreg 维持的 ICOSL-ICOS 信号通路不仅在 Treg 细胞中富集,而且在常规 CD4 + T 细胞亚群中也富集(图 4F和图 S5A)。同样,在老年样本中,CD278 + CD4+ T 细胞数量增加,常规 CD4 + T 细胞显示出 eTreg 相关基因的高表达。使用 NicheNet 分析,发现 IL-6 始终是衰老个体中关键的潜在调节因子,而在高龄组或所有 Treg 细胞中均未观察到(图 4G)。 IL-6 通过其受体潜在地调控了衰老个体 Treg 细胞中多种上调基因,包括 eTreg 相关基因,例如BATF、PRDM1和ICOS (图 4H-I)。此外,他们观察到两种 Treg 相关免疫抑制分子 IL-10 和 TGF-β1 的 mRNA 水平在健康老年个体(年龄 ≥ 50)中保持相对稳定(图 4J)。然而,在衰老个体中,这些分子的血浆蛋白水平显著升高(图 4K)。
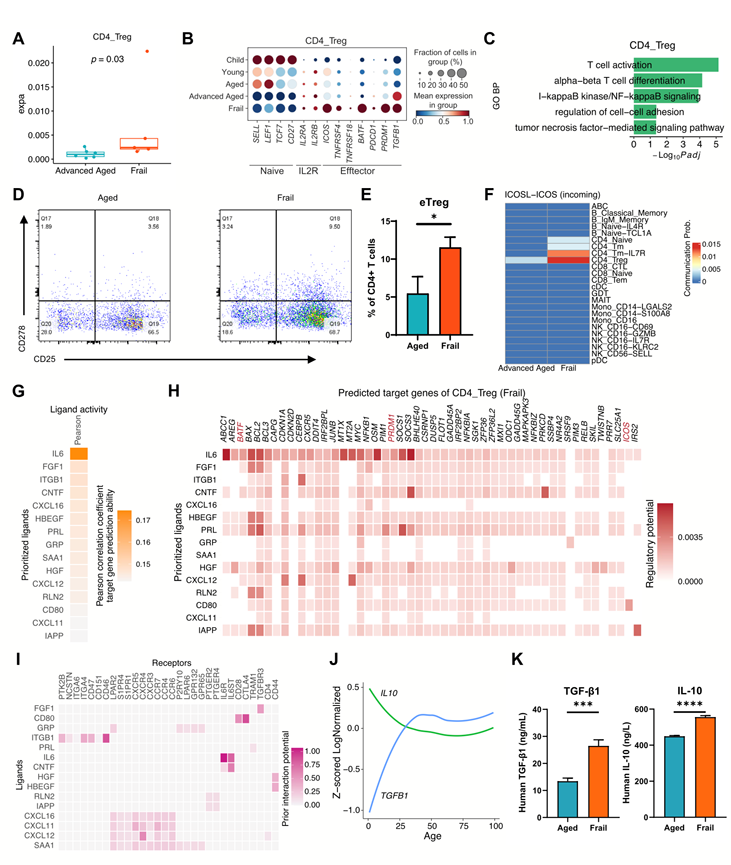
图4. 衰老状态下Treg细胞的激活。
(A)箱线图比较CD4_Treg细胞的TCR克隆扩增。Wilcoxon秩和检验。(B)点图显示不同年龄组CD4_Treg细胞中选定基因的表达情况。(C)与健康高龄个体相比,衰老个体CD4_Treg细胞中上调基因的GO生物学过程项显著富集。(D) eTreg细胞(CD278+ CD25+ CD4+ T细胞)的门控策略。(E)条形图显示CD4 + T细胞中eTreg的百分比。(F)每种细胞类型的ICOSL-ICOS信号传入通信概率。 (G) NicheNet 分析体弱者和高龄供者的 Treg 细胞中上调基因集。热图显示对体弱供者的 Treg 细胞基因表达具有最高预测能力的前 15 种配体。(H) NicheNet 配体-靶基因矩阵热图表示体弱供者的 DEG 的前 15 种配体与 Treg 细胞中靶基因之间的调控潜力。与 eTreg 细胞相关的基因以红色显示。(I) Treg 细胞的潜在受体与图4G的前 15 种配体相互作用。(J) 折线图显示TGFB1和IL10 的表达轨迹随年龄的变化。(K) 老年体弱捐献者的血浆TGF-β1(左)和IL-10(右)蛋白水平。
05
衰老状态下细胞毒功能的抑制
在体弱的老年个体中,CD4 + T 细胞,特别是 Treg 细胞向免疫抑制表型的转变引发了人们对细胞毒性细胞功能潜在改变的担忧。在体弱个体中,CD8_CTL 和 NK 细胞中细胞毒性相关基因的表达和整体功能评分降低,而在健康老年组中,这些下降更为缓慢(图 5A-D)。相反,CD8_CTL 细胞中衰竭相关基因的表达和整体衰竭评分增加(图 5A-B)。此外,IFN-II 细胞间相互作用网络仅在健康老年个体中富集,并由 NK 细胞亚群和 γδT 细胞的输出驱动(图 5E)。流式细胞分析还显示,与老年健康捐赠者相比,衰老个体的PD-1+ CD8+ T 细胞和 KLRG1+ CD57+ CD8+ T 细胞比例较高,而 GZMB+ CD8+ T 细胞比例较低(图 5F)。同样,与衰老的虚弱个体相比,健康老年个体的颗粒酶 B 和 IFN-γ 血浆蛋白水平较高(图 5G)。这些发现表明,虚弱个体的外周免疫状态失调,其中促炎和抗炎反应之间的失衡可能是由 SASP-单核细胞增加和 IL-6 诱导的 Treg 细胞活化引起的,导致细胞毒性细胞功能受到抑制,消除异常免疫细胞的能力降低(图 5H)。
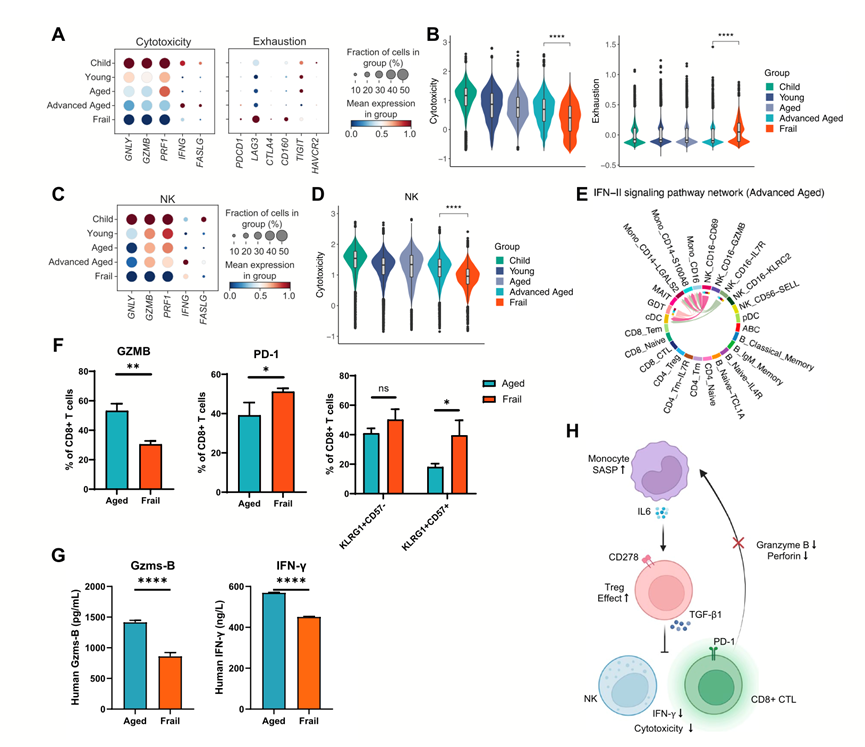
图5. 衰老状态下细胞毒功能的抑制。
(A)点图显示不同年龄组的 CD8_CTL 细胞中细胞毒性和衰竭相关基因的表达。(B)小提琴图显示不同年龄组的 CD8_CTL 细胞的细胞毒性(左)和衰竭(右)功能评分。(C)点图显示不同年龄组的 NK 细胞中细胞毒性相关基因的表达。(D)小提琴图显示不同年龄组的 NK 细胞的细胞毒性功能评分。(E)弦图显示老年个体 PBMC不同细胞类型之间的 IFN-II 信号通路活性。(F)条形图从左到右显示老年和体弱供体中GZMB +、PD-1 +、KLRG1 + CD57 −和 KLRG1 + CD57 + CD8 + T 细胞的百分比。NS 不显著。(G)老年和体弱供体的血浆中 Gzms-B 和 IFN-γ 蛋白水平。(H)体弱老年人外周免疫细胞炎症反应增强和免疫抑制的示意图。
+ + + + + + + + + + +
结 论
本研究对 PBMC 进行了多组学整合分析,涵盖了从儿童到体弱老人的人群,观察到 PBMC 转录组在健康衰老过程中的动态变化,包括早期炎症、髓系细胞和淋巴细胞特征的显著变化,以及后期相对稳定的状态。相反,体弱的老年人表现出外周免疫细胞的显著紊乱,包括单核细胞衰老表型增加、炎症细胞因子表达增高、调节性 T 细胞效应子活化增强以及细胞毒性淋巴细胞功能受损。总而言之,本研究为免疫衰老的复杂动态提供了宝贵的见解,阐明了导致体弱人群异常炎症和免疫抑制的机制。
+ + + + +



 English
English


