文献解读|Cell(45.5):小鼠组织和脑区蛋白质组和磷酸化蛋白质组的周转图谱
✦ +
+
论文ID
原名:Turnover atlas of proteome and phosphoproteome across mouse tissues and brain regions
译名:小鼠组织和脑区蛋白质组和磷酸化蛋白质组的周转图谱
期刊:Cell
影响因子:45.5
发表时间:2025.03.20
DOI号:10.1016/j.cell.2025.02.021
背 景
蛋白质周转是所有生物体中蛋白质持续合成和降解的基本过程。蛋白质周转对于维持蛋白质稳态、替换受损蛋白质和确保组织的功能完整性至关重要。虽然参与基本细胞功能的管家蛋白必须跨组织表达,但不同组织有不同的需求,必须以不同的方式作出反应以维持体内平衡。靶向特定组织中合成和降解迅速的蛋白质可以增强治疗效果,同时最大限度地减少对周转较慢的组织的影响。此外,蛋白质周转是翻译后水平的关键分子调控层,缓冲、调节或放大蛋白质组丰度的变异。多拷贝蛋白质的高周转率会给细胞带来能量消耗,这可能预示着这些蛋白质在组织特异性功能中发挥着关键作用。因此,对哺乳动物组织中的蛋白质丰度(PA)和蛋白质半衰期(PT)进行全面分析可以增强对细胞和组织特异性“经济”原理的理解,并提供重要的生物医学见解。
实验设计
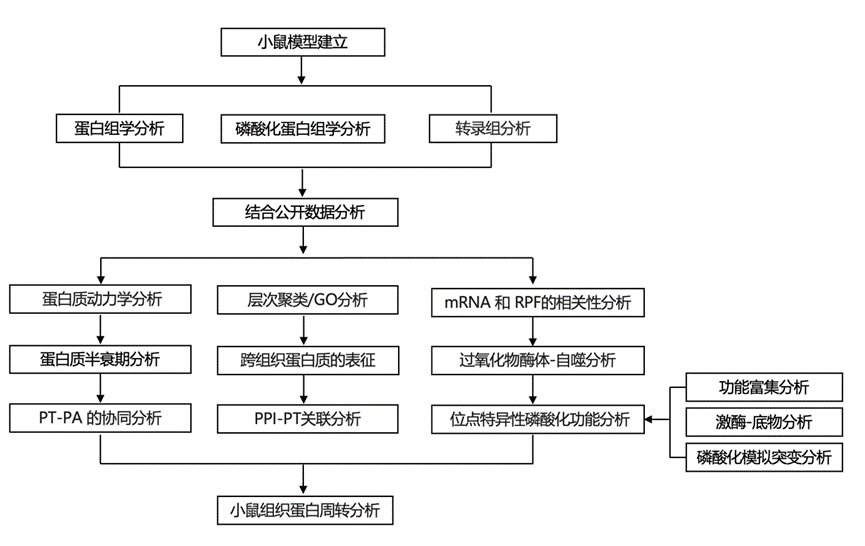
结 果
01
小鼠组织和大脑区域的深入定量蛋白质周转景观
研究团队以心脏、肝脏、脾脏、肺脏、肾脏、肠道、血浆和九个脑区(包括小脑、额叶皮质、黑质、丘脑、杏仁核、内嗅皮质、海马和嗅球)的蛋白质半衰期(即T50,以下简称PT)为指标,分析了蛋白质组范围内的蛋白质周转动力学(图1A)。使用pSILAC标记的含赖氨酸-6的食物,分别喂养小鼠8天和32天,测量体内PT。首先使用全脑组织的三个生物学重复和五个标记时间点(包括第 0 天)验证了该方法,然后将其应用于在两个生物学重复中使用数据独立采集(DIA-MS)和串联质量标记(TMT)进行多组织蛋白质组学测量,共生成1200个MS原始文件。特别是,为了提高蛋白质周转定量的精度,他们为 DIA-MS 实施了 BoxCarmax-DIA 多路复用方案,并对 TMT进行了广泛的肽级分馏(> 80 个级分),以有效降低确定重链与轻链 (H/L) 比率的 MS/MS 数据复杂性。随后采用基于常微分方程 (ODE) 的计算框架对氨基酸循环进行建模,并拟合 DIA-MS 和 TMT 数据集的赖氨酸-6 动力学(图 1 A)。DIA-MS和TMT技术在不同蛋白质之间以及不同组织之间生成的蛋白质半衰期数据具有高度一致性和可重复性(图1B-C)。DIA-MS 和 TMT 在组织中的蛋白质特异性 PT 相关性也很高(图 1 D),而 TMT 总体上比 DIA-MS 多出约 15% 的蛋白质 PT 值。
通过整合所有测量结果,他们定量并组装了所测量组织和大脑区域中 11171 个独特蛋白质组的半衰期数据。平均而言,在非血浆组织中检测到 9214 种蛋白质并对其丰度进行了定量,并且从来自相同数据集的含赖氨酸肽中测量了每个组织平均 7075 种蛋白质的周转率(图 1 E )。他们开发了Tissue-PPT技术,这是一个网页应用程序,支持对此数据集的单个蛋白质和蛋白质列表级别探索。Tissue -PPT的分析深度与最近对小鼠组织的大规模蛋白质组作图工作相当,但它使跨多个组织测量的 PT 数量增加了两倍。例如,使用赖氨酸-8 SILAC 标记,其他研究团队检测了五种小鼠组织类型的蛋白质周转率,包括肝脏和血浆。相比之下,Tissue-PPT测量了 6077 种肝脏蛋白质和 516 种血浆蛋白质的半衰期。同样,Hasper 等人利用15 N 标记分析了四种组织,包括肝脏和心脏,而Tissue-PPT确定了心脏中 6492 种蛋白质的周转率。他们发现Tissue-PPT覆盖了 Hasper 等人测量的 84.6% 的心脏蛋白质,并报告了高度相关的 PT(图1F-H)。令人欣慰的是,基于蛋白质 DIA-MS 信号,Tissue-PPT有效测量了更多低丰度蛋白质的周转率(图 1 H)。在比较肝脏蛋白质组结果时也观察到了类似的结果,证实了 Tissue-PPT 具有相当的分析深度。
跨组织的整体蛋白质组周转模式显示出中等相似性,大多数蛋白质组(66.7%–80.04%)的 PT 少于 10 天,表明小鼠的基础代谢动态(图 1 I)。血浆蛋白质组包含由不同组织产生并释放到血液中的蛋白质。基于在血浆和每种实体组织中检测到的 300 多种蛋白质,他们发现血液蛋白质在血浆中的半衰期通常比在组织和脑区域中的半衰期更长,这可能是由于血液中缺乏泛素(Ub)-蛋白酶体系统(UPS)。由于通过 MS 方法可以在粗血浆样本中检测到的蛋白质数量很少,他们在后续的分析中重点关注组织和脑区域之间的 PT。
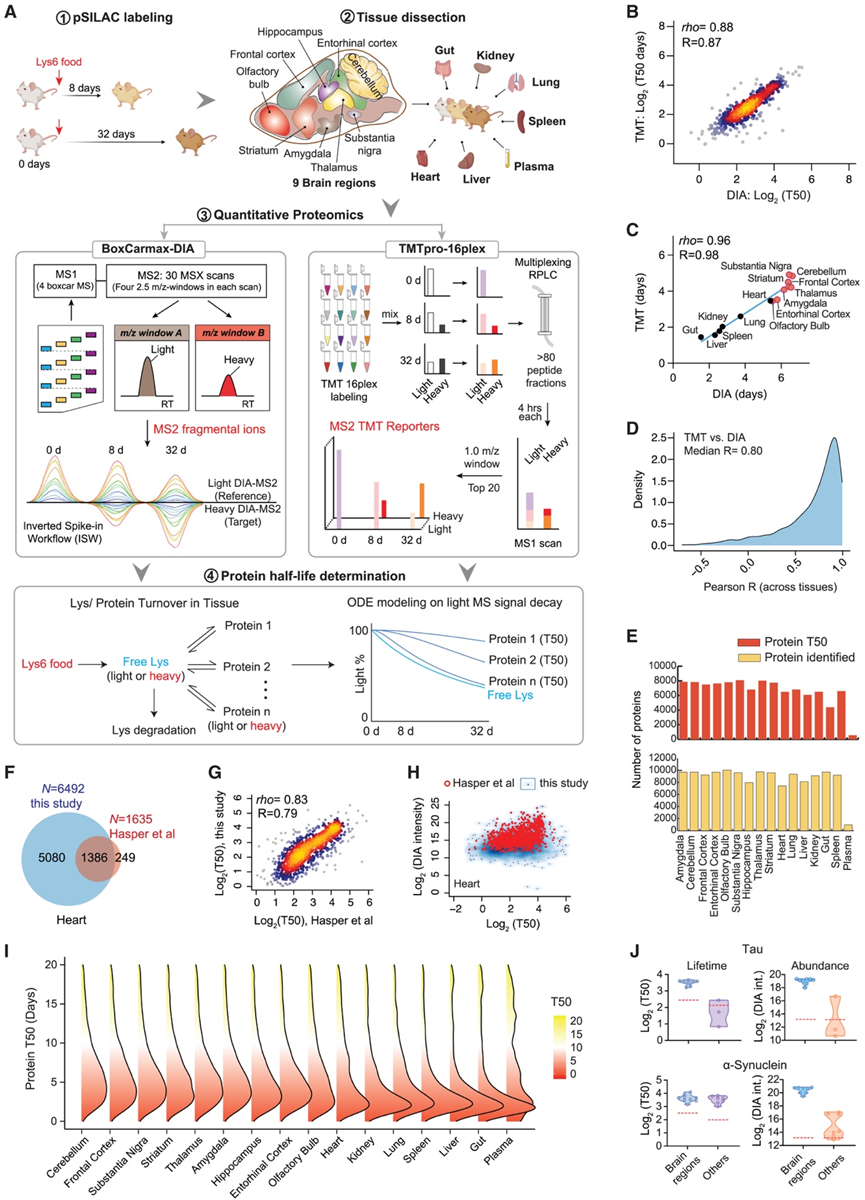
图1. 生成小鼠组织和脑区高质量蛋白质周转图谱。
(A) pSILAC-MS 工作流程用于小鼠跨组织蛋白质周转分析。(B) 基于所有组织的平均值,通过 DIA 和 TMT 方法对蛋白质组中 PT 进行相关性分析。(C) 基于 DIA 和 TMT 量化的每个组织的平均 PT 值对每个组织内的 PT 进行相关性分析。(D) DIA 和 TMT 之间 PT 相关性的 Pearson R 密度图。(E) 蛋白质组覆盖范围包括蛋白质鉴定和蛋白质半衰期分析。(F) 维恩图比较了本研究与 Hasper 等人的研究结果。(G) 两项心脏蛋白质组研究的 PT 的 Spearman 相关性。(H) 本研究与 Hasper 等人的 MS 强度和 PT 比较(红点)。(I) 跨组织的 PT 密度图。(J) 小提琴图显示 Tau 和 α-突触核蛋白的质谱强度和PT。
02
PA 和 PT 分析共同定义组织蛋白质组的功能和稳定性
蛋白质周转描绘了一个很大程度上独立于蛋白质表达的功能维度。本研究整合了相同蛋白质的匹配的 PA 和 PT,这可能增强对组织中蛋白质必要性的理解。例如,通过检查微管相关蛋白 Tau (MAPT) 和 SNCA,证实这两种蛋白质在脑区中的丰度显著高于其他组织。此外,虽然 SNCA 在脑和其他组织中的半衰期相当,但 Tau 在脑中的半衰期明显更长(图1 J),在脑中它很容易积累变化,从而导致诸如 tauopathies 等病理进展。
为了从 PA 和 PT 探索生物学见解,他们首先使用主成分分析 (PCA) 检测了 PA 和 PT 数据集的总方差。正如预期的那样,在 PA 和 PT 的 PCA 中,所有大脑区域都形成了一个与其他组织分离的独特聚类(图 2A),表明大脑区域之间的生物学变异较小。肠道的 PT 在实体组织中表现为异常值,可能是因为其细胞增殖速度较快。总体而言,PA 和 PT 的跨组织相关性分析显示 PCA 结果趋势相似(图 2B),表明蛋白质稳态多样性显著。接下来,他们根据 5% 最短和最长半衰期蛋白质在大脑区域和非脑组织中的平均 PT 对其功能进行了注释(图 2C)。有趣的是,他们鉴定出富集短半衰期或长半衰期蛋白质的不同生物学过程(图 2D)。 “核心基质体”和“有氧呼吸”与长半衰期蛋白质有关,而“DNA损伤反应”和“蛋白质多泛素化”与快速周转有关,这些都与以前的报道一致。为了了解PT对PA的依赖性,他们分析了不同蛋白质功能类别的所有组织中PA和PT之间的相关性(图2E)。该分析表明,某些蛋白质组,如分子伴侣复合物、呼吸链复合物I和参与器官形成的蛋白质,在PA和PT之间表现出正相关性,表明蛋白质表达和半衰期之间存在协调。相比之下,来自核糖体和48S前起始复合物的蛋白质没有甚至显示出PA-PT相关性,这表明细胞利用蛋白质周转来调节蛋白质生产机制,从而促进组织稳态。
接下来,为了说明 PA 和 PT 的协同分析,他们开发了热环 (HC) 图谱。该图中,基于DIA-MS数据计算的强度绝对定量值(iBAQ,反映蛋白质拷贝数)转化为相对iBAQ值(riBAQ,以百万分比ppm表示),用于确定圆圈大小;红-蓝渐变色标则表征蛋白质(或蛋白质集合)的半衰期,红色代表短半衰期蛋白,蓝色代表长半衰期蛋白(图2F)。热圈图从多层级(组织、功能蛋白群、细胞器、亚细胞结构及单个蛋白质)直观呈现了蛋白质组的稳定性特征与细胞能量分配模式。在细胞器水平上,HC 图揭示了 EM 在整个组织中持续富集长半衰期蛋白质,这表明与其他细胞成分相比,EM 蛋白质的周转并不快。类似的模式也出现在质膜成分中,例如溶质载体 (SLC) 蛋白,它们可能对于维持组织完整性至关重要。胶原蛋白虽然数量少,但在非脑组织中含量丰富,且在所有组织中半衰期极长,反映了它们在维持组织结构中的关键作用。相比之下,线粒体和核蛋白表现出更高的跨组织变异性,表明组织特异性的动态调节。在亚细胞器水平上,HC 图显示,与其他组织和其他线粒体蛋白(如线粒体核糖体亚基)相比,脑中的呼吸链复合物 I 蛋白具有更高的丰度和更长的半衰期,强调了氧化磷酸化在脑中的重要性,与图 2D一致。在单个蛋白质水平上,SLC 表现出广泛的 PA,但在不同组织中具有相似的 PT。有趣的是,某些蛋白质,例如线粒体核糖体中的 Mrps24、呼吸链复合物 I 中的 MTND1、EM 中的 HSP90aa1 和 Hsd17b12,以及 SLC 中的 Slc4a1 和 SLC12a5,其半衰期与其复合物和功能类别中测量的半衰期不同,这可能表明蛋白质在组织中具有与其复合物无关的兼职功能。总之,Tissue-PPT应用程序支持的 HC 图(其中 PA 可以以 riBAQ、iBAQ 或 DIA-MS 强度等级显示)可有效地可视化 PA 和 PT,从而为组织功能多样性提供互补的见解。
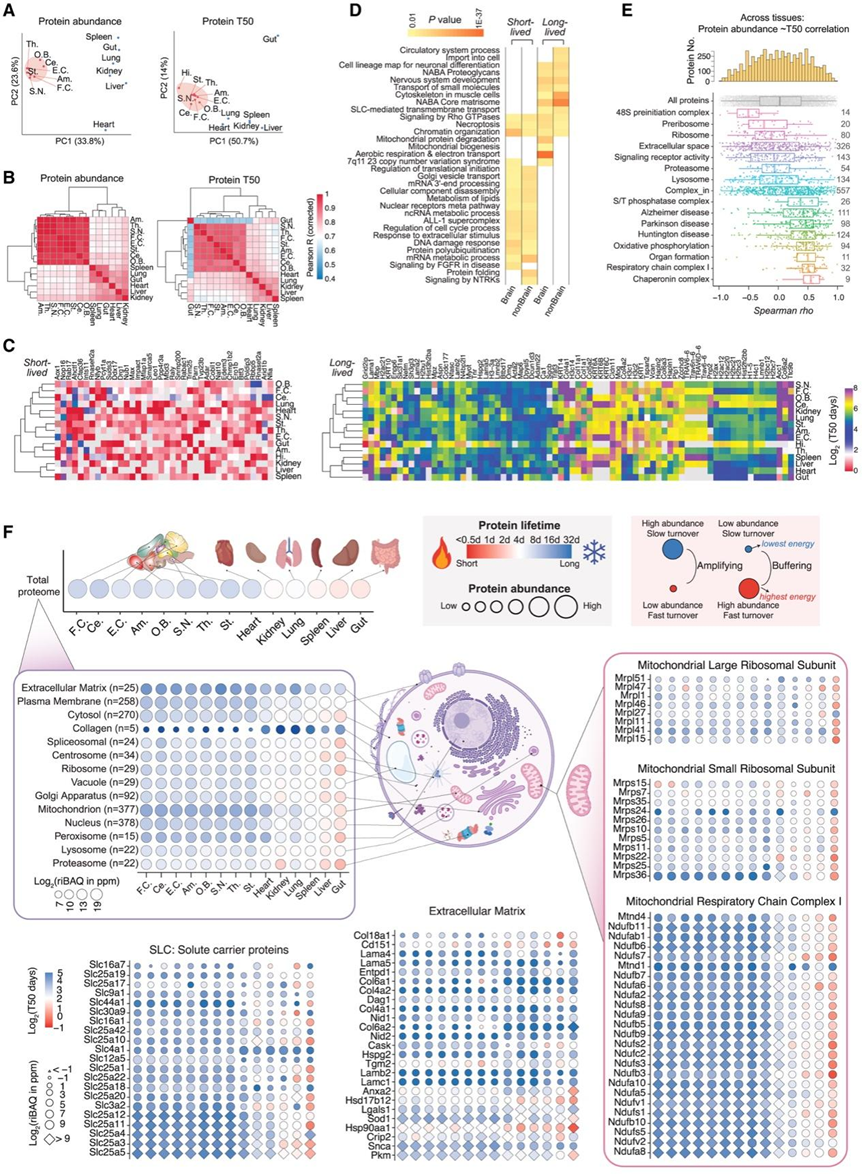
图2. 小鼠组织蛋白质组的蛋白质丰度和半衰期同时分析。
(A) 脑区和实体组织中 PA 和 PT 的 PCA。(B) 层次聚类热图显示基于 PA 和 PT 的组织和大脑区域之间的Pearson 相关性。(C) 层次聚类热图显示基于 PA 和 PT 的组织和大脑区域之间的Pearson 相关性。(D) 基于脑区和非脑组织中的平均PT,富集在5%最短和最长半衰期蛋白质中的生物过程。(E) 基于脑区和非脑组织中的平均PT,富集在5%最短和最长半衰期蛋白质中的生物过程。(F) 热环 (HC) 图可视化不同细胞组织水平的组织中 PA 和 PT。
03
E3连接酶的半衰期多样性对于确定组织特异性蛋白水解至关重要
为解析不同组织的蛋白质降解特征,他们对主要细胞蛋白降解系统进行了PA与PT分析,包括:蛋白酶体、溶酶体、E3泛素连接酶(E3)、E3辅助蛋白、去泛素化酶(DUBs)及蛋白质折叠伴侣(图3)。通过热圈图分析发现19S与20S蛋白酶体各亚基间呈现严格的PA协同调控,且跨组织PT高度相关(图3A)。肾脏组织中蛋白酶体周转速率显著快于整体蛋白质组(图2F),这可能与其需要高效降解肾小球滤过的大量蛋白质和小肽的功能需求相关。溶酶体蛋白表现出更广的PA动态范围和变异性(图3B-D)。其中脑区溶酶体酶(如Man2b1、Pla2g15和Capn1)呈现极短半衰期特征;而脾脏溶酶体蛋白相对长半衰期(图3C),可能与其免疫监视和吞噬功能相关。DUB在所有组织中保持最稳定的PA水平(图3D),提示去泛素化核心功能具有普适性需求。作为降解系统中丰度最低的组分,E3连接酶及其辅助蛋白却表现出最强的PT组织差异性(图3D-E)。这一发现凸显了蛋白质降解的关键调控节点(如E3连接酶通路)可通过组织特异性周转速率差异来维持差异化的蛋白质稳态需求。
为探究泛素(Ub)在不同组织中的利用特征,他们通过DIA-MS数据对Ub修饰特征肽段进行了系统分析,重点解析了基于不同赖氨酸(K)残基(包括K48、K63、K11、K27和K6)形成的多聚泛素链分布(图3F)。非标记定量分析显示,在经典泛素-蛋白酶体系统(UPS)中起核心作用的K48泛素链是所有组织中的主要类型。与脑区蛋白质缓慢周转的特性一致,观察到脑组织中K48泛素链水平最低。值得注意的是,K48泛素链一旦合成,在大多数组织中的保留时间显著长于K63泛素链及其他蛋白质(图3G)。这一发现可能揭示了K48泛素链介导的底物去泛素化与降解过程的耦合机制,以及不同类型多聚泛素链的差异化回收策略。肝脏组织表现出K63泛素链的异常快速周转特征,这可能与其在内吞作用和自噬等多种信号通路中的特殊功能需求相关。
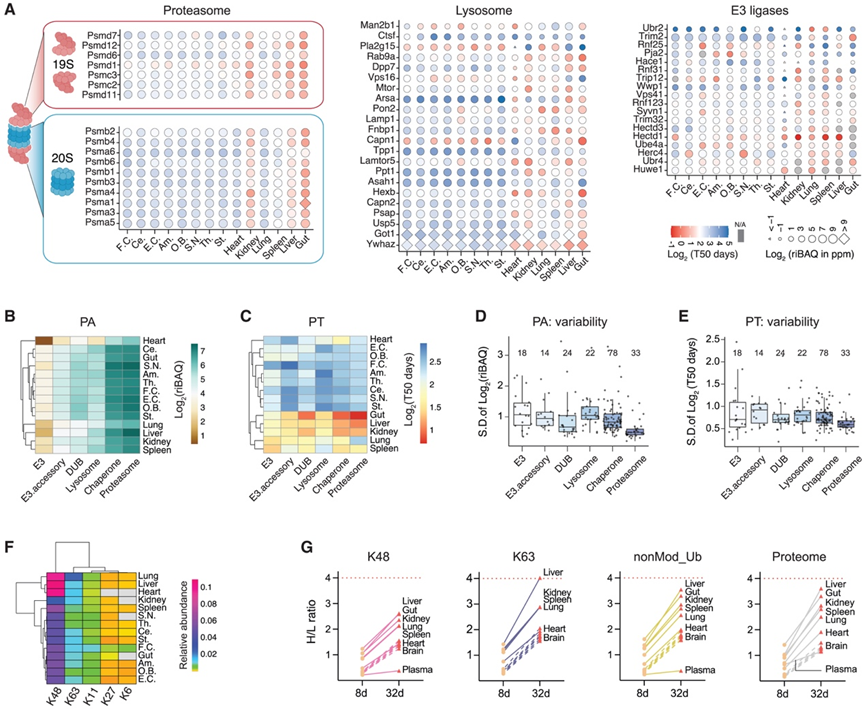
图3. 跨组织蛋白质去除过程的表征。
(A) 蛋白酶体亚基(19S 和 20S)、各组织溶酶体蛋白以及各组织 E3 泛素连接酶的 HC 图。(B) 五种代表蛋白质降解机制的蛋白质的PA谱的层次聚类热图。(C) PT曲线热图。(D) 每个蛋白质列表的标准差(SD)的箱线图,表明PA在不同组织中的差异。(E) 每个蛋白质列表的 SD 的箱线图表明不同组织之间的 PT 变异性。(F) 泛素 (Ub) 连接 K63、K48、K27、K11 和 K6 在组织中的层次聚类热图。(G) pSILAC 标记 K48 和 K63 连接的泛素、基于肽 TLSDYNIQK 的未修饰泛素以及平均蛋白质组时的重链与轻链 (H/L) 比值。
04
PT 与组织中的 PPI 紧密相关
在活细胞中,蛋白质很少单独发挥作用。当两个蛋白质发生物理相互作用(PPI)时,研究者会很自然地会假设它们的合成与降解过程存在协同调控。先前研究表明,同一细胞器、蛋白家族或复合物中的成员往往具有相关的PT。近期,Skinnider等人通过蛋白质相关性谱分析质谱技术,构建了跨小鼠多种组织的全面PPI数据集。他们将该数据集与Tissue-PPT平台整合,首次实现了跨组织PPI与PT的精细关联分析。基于CORUM、BioPlex和Skinnider三个数据库的分析均显示,PPI配对蛋白间的PA相关性显著高于随机非互作蛋白对(图4A),这与已知的通过PPI组织的蛋白质组机制一致。跨组织PT分析呈现更显著的相关模式(图4B),Skinnider数据集与本研究PT数据重叠的107553个PPI中,PPI配对蛋白的PT相关性(平均Pearson系数0.53)是非互作蛋白对(0.07)的7.6倍,该效应强度远超CORUM和BioPlex数据集(分别仅2.69和14.76倍)。
通过hu.MAP人类蛋白质复合物图谱的置信度分级分析发现,对于最高置信度的PPI(等级5),PT的区分能力显著优于PA(图4C),这些发现不仅证实了组织特异性PPI网络解析的重要性,更揭示了PT对PPI的依赖性这一长期受到低估的调控维度。
他们进一步通过受试者操作特征曲线(ROC)分析探究跨组织蛋白质PT相关性是否足以预测PPI。本研究将hu.MAP数据库中置信度等级4(高)或5(极高)的PPI作为"真阳性",同时选取相同数量的未在任何上述资源中收录的随机蛋白质对作为"阴性对照"。研究发现,仅PT数据即可有效预测PPI(图4D)。值得注意的是,PT与蛋白质丰度(PA)联合分析的曲线下面积(AUC)达到0.89,且二者协同分析对hu.MAP PPI的预测效果优于CORUM和BioPlex数据库,这凸显了利用跨组织PT和PA数据预测或优化动物PPI网络的潜力。需要说明的是,该ROC分析基于PA和PT的跨组织相关系数,因此无法预测组织特异性PPI。有趣的是,基于Skinnider等报道的组织特异性PPI证据,通过比较特定组织中某蛋白与其PPI伴侣的PT差异,他们鉴定出一批具有持续性周转速率差异的PPI对(图4E),如Agrn-Psmd1、Lmnb2-Lmna,以及在肝脏和肾脏中呈现差异的Map2-Ak2。这些结果表明,这些表现出特殊"PT偏离"特征的蛋白质可能存在额外的功能。
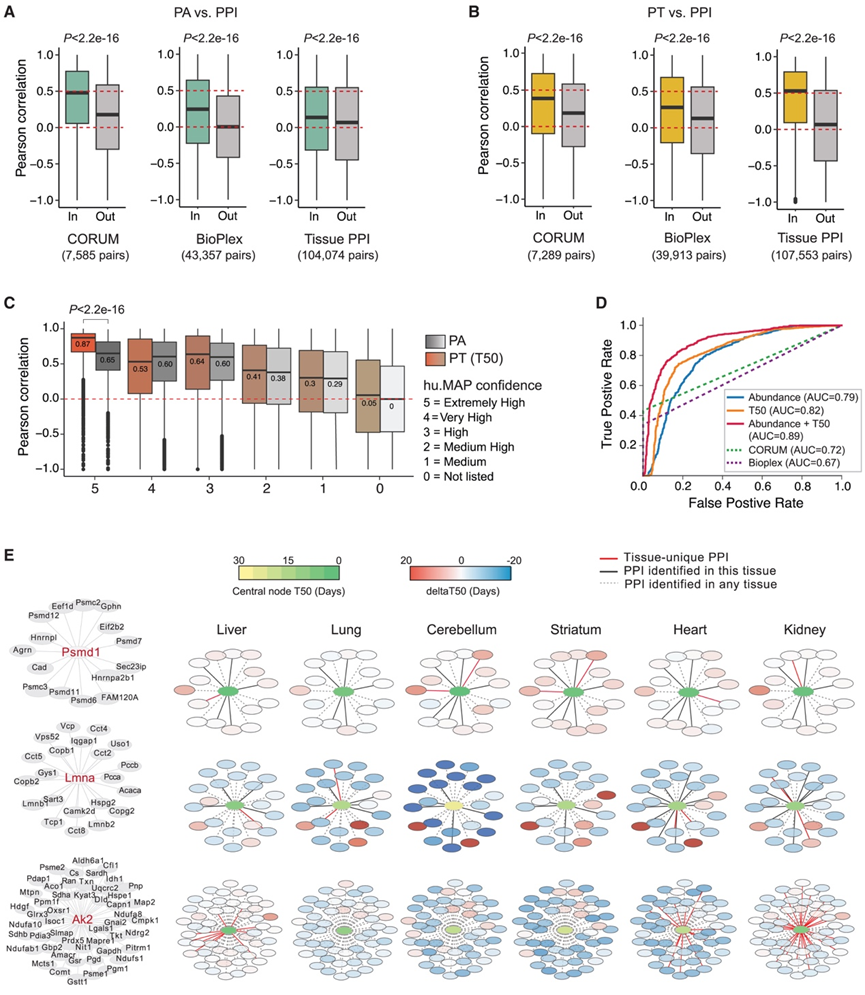
图4. 跨组织蛋白质半衰期与PPI的关联。
(A) PPI之间 PA 的二元相关系数 (Pearson R) 箱线图。(B) PT箱线图。(C) 与(A)相同的箱线图,分别表示PA和PT,并使用hu.MAP中的PPI置信水平。1-5级表示PPI置信水平增加。(D) ROC 曲线显示 PA、PT 及其逻辑回归组合的 PPI 预测能力,以及 CORUM 和 Bioplex 衍生的列表。(E) PSMD1、LMNA 和 AK2 蛋白的 PPI在代表性组织中的 PT 可视化。
05
多组学分析揭示过氧化物酶体蛋白的组织特异性半衰期变化
他们将Tissue-PPT与公开的数据集整合,该数据集描述了转录组和翻译谱——分别使用转录组分析(RNA-seq)和核糖体保护RNA片段(以下简称RPF)测序分析——来自六种小鼠组织,其中五种与Tissue-PPT中的组织(肝脏、心脏、肺、肾脏和脑)重叠。在所有五种组织中,RPF数据与蛋白质合成速率估计替代指标的相关性优于本研究中基于MS测量的蛋白质iBAQ值(图S5 A-B),这证实了RPF数据在研究整体翻译调控方面的相关性。
首先,他们对每个组织的所有蛋白质进行了多层绝对相关性分析。mRNA 和 RPF 数据之间的相关性最高。在此数据集中,RPF 与蛋白质组之间的相关性以及 mRNA 与蛋白质组之间的相关性均较低且具有可比性(图 5 A)。此外,绝对 PT 与绝对 PA 表现出弱相关性或无相关性,但与翻译的 mRNA 和 RNA 水平呈轻微但显著的负相关性。该结果与已报道的蛋白质周转在整体调节转录和翻译调控以微调组织中功能性蛋白质组中的缓冲作用相一致。其次,为了辨别哪一层驱动特定的组织蛋白质型,他们比较了跨组织的多层相关性,包括所有组织中鉴定的蛋白质(图 5 B)和特定组织中 PA 水平高出 4 倍以上的蛋白质。他们发现组织富集蛋白质主要受蛋白质合成之前的调控步骤的影响,而不是受蛋白质周转的影响,因为 mRNA、RPF 和蛋白质组之间的相关性比 mRNA 或 RPF 与 PT 之间的相关性强得多,DIA 和 TMT 衍生的 PT 均证实了这一点(图 S5C)。第三,为了确定某些蛋白质和功能的蛋白质周转是否发生了特别的变化,他们进行了GO分析,探究细胞区室的蛋白质特异性相关性(图 5 C)。该分析表明,与其他细胞器蛋白相比,过氧化物酶体蛋白的 mRNA 与 PT、RPF 与 PT 以及蛋白质与 PT 之间存在显著的负相关性,这表明过氧化物酶体的 PT 与蛋白质生成呈现出有趣的相反趋势。然后,他们比较了每个细胞器中 mRNA、RPF、PA 和 PT 的平均水平(图 5D),以及组织中单个过氧化物酶体蛋白的平均水平,发现了蛋白质特异性的跨层相关模式(图 5E-F)。60% 的过氧化物酶体蛋白虽然转录和翻译水平相对较低,但半衰期较长,而其余 40% 则表现出相反的特征(即转录/翻译水平较高但半衰期较短)(图 5F)。比较过氧化物酶体蛋白和其余蛋白质组,发现过氧化物酶体蛋白在肝脏中的周转率显著加快,在心脏中的半衰期更长(图 S5F),表明过氧化物酶体蛋白可能存在组织依赖性的半衰期调控。
先前的研究报告称,过氧化物酶体受一种称为过氧化物酶体自噬的选择性自噬降解过程的调控,并且过氧化物酶体的生化通路在不同器官中具有特异性。在本研究的数据中,他们观察到过氧化物酶体自噬相关蛋白的丰度与组织中总体溶酶体水平之间存在显著相关性(图 S5 G)。此外,使用Tissue-PPT生成的 HC 图和单独的 PA-PT 相关图均显示,对于 Pex3(过氧化物酶体自噬的重要激活因子)和 Atg12(一种对自噬体形成和跨组织自噬至关重要的 Ub 样蛋白),PA 与 PT 呈负相关性(图 S5 H-I)。总之,这项多组学分析强调了特定组织中特定过氧化物酶体蛋白的半衰期多样性,可能使细胞能够快速适应细胞应激和代谢需求。
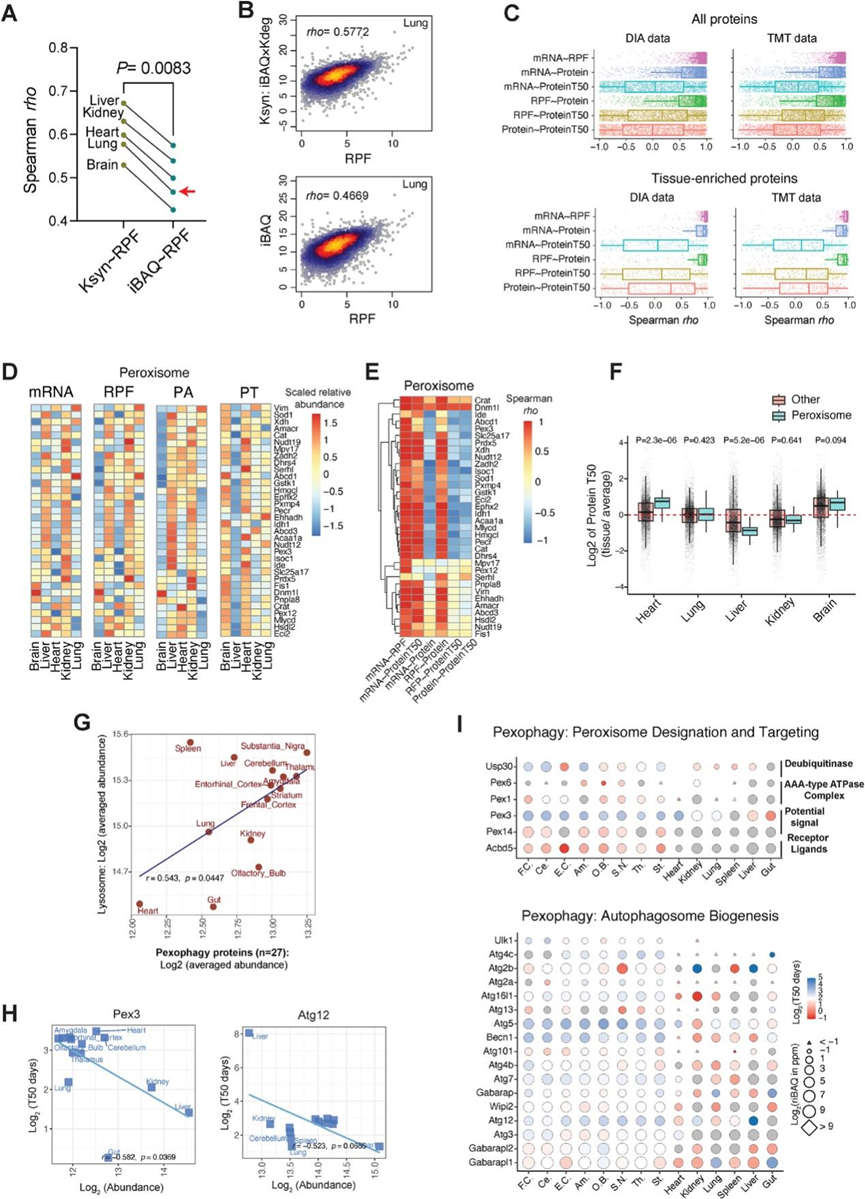
图S5. 过氧化物酶体和自噬蛋白的多组学分析。
(A) 五种组织中RPF(核糖体保护片段测序)与 MS 衍生的 Ksyn (蛋白质合成速率的替代指标)和 iBAQ 值的 Spearman 相关性。(B) 以肺组织为例,将 log2 RFP 与 K syn (上图)进行 Spearman 相关性分析,并与 log2 iBAQ(下图)进行对比。(C) 基于 DIA(左)和 TMT(右)得出的结果,所有检测蛋白质(上)和组织富集蛋白质(下)的多组学层之间的蛋白质特异性 Spearman 相关性rho值的箱线图。(D) 使用mRNA、RPF、PA和PT层的定量值绘制的五种组织中单个过氧化物酶体蛋白的热图。(E) 热图可视化了跨组织两个组学层之间每个过氧化物酶体蛋白的Spearman相关性。(F) 箱线图探索不同组织中过氧化物酶体蛋白与蛋白质组中其他蛋白质的相对PT。(G) 自噬相关蛋白丰度与溶酶体蛋白水平的相关性。(H)参与过氧化物酶自噬的Pex3和Atg12等蛋白质样本的log2(蛋白质丰度)与log2(T50)之间的相关性。(I) 参与过氧化物酶体定位和靶向以及自噬体生物合成等过氧化物酶体自噬相关过程的蛋白质的HC图。
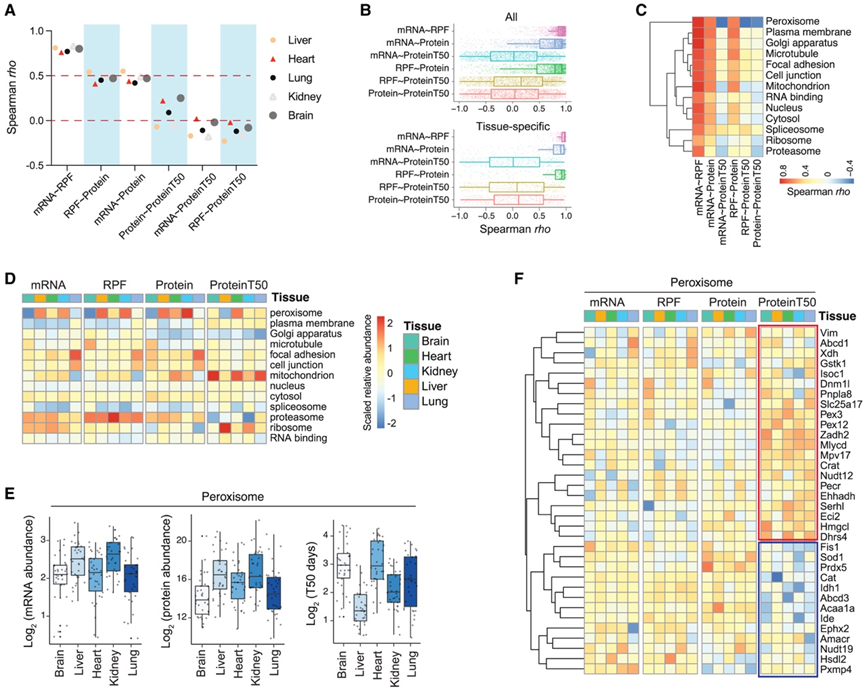
图5. 跨组织多组学分析和过氧化物酶体蛋白的周转控制。
(A) 五种组织中mRNA、RPF、PA和PT测量值的蛋白质组范围绝对Spearman相关性。(B) 所有测量蛋白质(上)和组织富集蛋白质(下)(蛋白质丰度至少比其他组织平均值高四倍)的多组学层之间的蛋白质特异性 Spearman rho 值的箱线图。(C) 热图可视化多组学层之间的跨组织 Spearman 相关性。(D) 跨多组学层的GO细胞组分定量结果(柱状图)热图。(E) 过氧化物酶体蛋白的 mRNA 丰度、PA 和 PT 水平的箱线图。(F) 五种组织中单个过氧化物酶体蛋白的多组学定量结果热图。
06
位点特异性磷酸化在组织中功能性地塑造PT
除了全蛋白质周转率外,Tissue-PPT还呈现了组织磷酸化(P)蛋白质组周转率概况。总体而言,DIA-MS 和 pSILAC-DIA 测定了 67169 个 P 位点的丰度和 40573 个 P 位点的 T50,从而描绘了体内磷酸化的大规模动态。在脑区和非脑组织中,他们分别定量了 34157 ± 2207 个和 22821 ± 4650 个带有 P 位点的肽段的丰度,并定量了其中 12861 ± 1441 个和 7575 ± 2681 个肽段的 T50(图 6 A)。相比之下,在血浆中仅定量了约 100 个 P 位点。磷酸化蛋白质组丰度和周转率变异的PCA图显示出与总蛋白质组结果相似的组织间和区域间模式(图6 B)。脑区间P位T50相关性明显强于组织间相关性,与总蛋白的T50结果相似(图6 C)。
为了探索位点特异性磷酸化如何改变不同组织中的蛋白质周转,他们利用了之前开发的 DeltaSILAC 方法,其中考虑了非磷酸化的蛋白质形式。DeltaSILAC本质上整合了 pSILAC、磷酸化蛋白质组学和肽水平匹配策略,最初应用于生长中的 HeLa 细胞。因此,在此,对于给定的 P 位点,他们比较了同一组织的整体蛋白质组学结果中磷酸化 (p) 肽的 T50与其非磷酸化 (np) 对应肽的 T50。他们分析将所有 P 位点的 p 和 np 肽的 T50值之间的相关性。共评估了106个激酶,每个激酶覆盖超过30个P位点底物,并用相应的T50对(百分位数> 0.99)进行定量分析(图6 D)。对于同一种激酶的底物,磷酸化诱导的T50改变可能存在显著差异。将此结果映射到激酶系统发育树中,他们观察到Ca2+/钙调蛋白依赖性蛋白激酶(CaMK)家族的底物在p肽和np肽之间总体上表现出较弱的T50跨组织一致性(图6 E)。相比之下,STE 家族表现出最强的相应 T 50相关性,例如 YSK1、TAO1、TAO2和 MYO3A,远高于 CaMK 的结果。因此,在受到特定激酶磷酸化后,P 位点的半衰期和相应的蛋白质水平半衰期可能受独立的体内机制调控。此外,利用脑区 T50的高数据完整性,他们还使用蛋白质水平功能注释进行了功能富集分析,发现脑区间 P 位点的丰度差异与电子传递链、内体和对内质网 (ER) 应激的反应。另一方面,大脑中 P 位点半衰期的变化往往与不同的过程有关,例如肌动蛋白成核和蛋白质在质膜上定位的正向调节。这表明 P 位点丰度的分布和 P 位点在大脑各区域存在的持续时间对大脑的复杂功能至关重要。
使用火山图(图 6 F),他们确定了 581 和 592 个 P 位点显著延长或缩短了脑区的T50,以及 146 和 105 个 P 位点在其他组织中也存在同样的情况。根据激酶库注释,加速脑内周转的 P 位点富集为激酶 TSSK2和 HUNK的底物,而那些稳定蛋白则富集为 SIK、NEK11和其他激酶的底物。此外,对于核孔蛋白、组蛋白变体和酶等体内极长半衰期蛋白质 (ELLP),他们在此处的数据鉴定出可进一步延长或微调其 PT 的特定 P 位点。
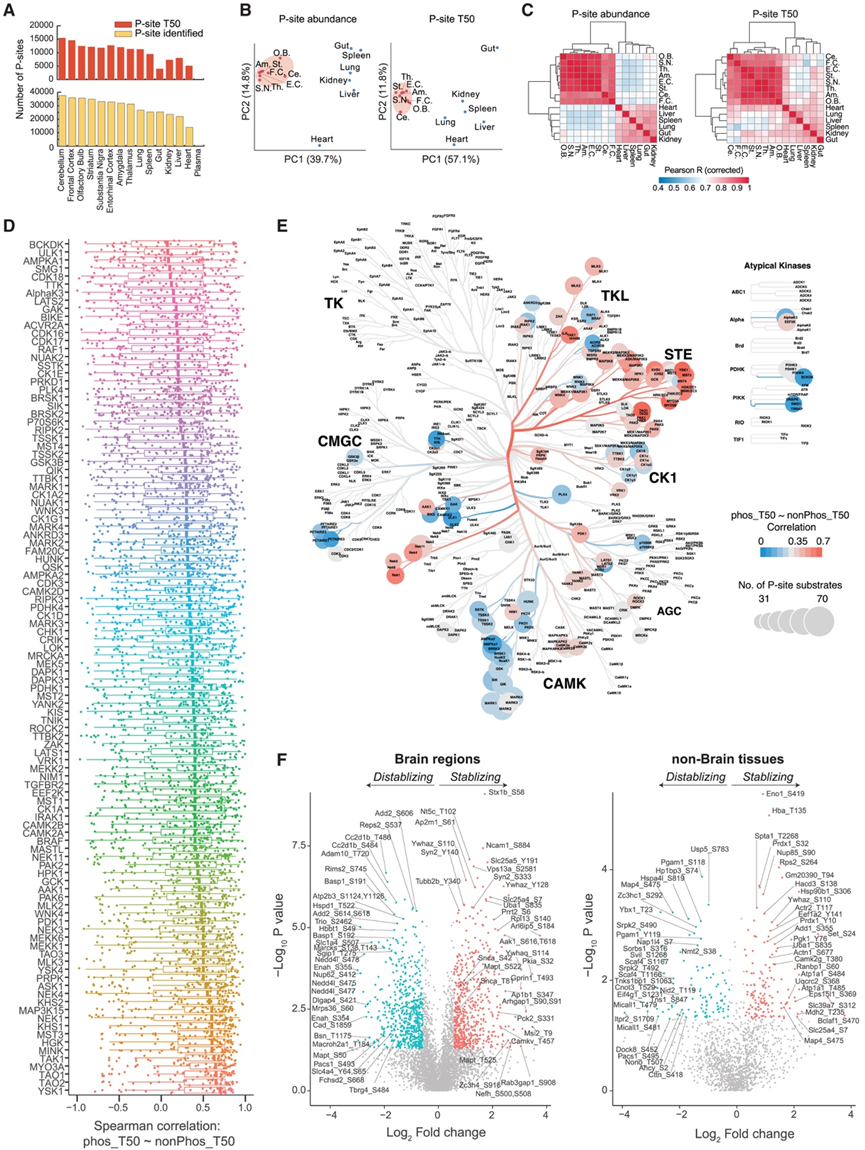
图6. 分析位点特异性磷酸化周转及其对小鼠组织的影响。
(A) 分析位点特异性磷酸化周转及其对小鼠组织的影响。(B) 跨组织 P 位点丰度和半衰期的 PCA 图。(C) 对组织间 P 位点丰度和半衰期进行 Pearson 相关性分析,其中蓝色到红色的颜色条表示 Spearman 校正后相关性增加。(D) 根据激酶-底物注释映射到激酶库的组织中所有特定 P 位点的磷酸化 (phos_T50) 和非磷酸化肽 (nonPhos_T50) 的 T 50之间的 Spearman 相关性分布。(E) 将不同组织中磷酸化肽段 (phos_T50) 和非磷酸化肽段 (nonPhos_T50) 的 T50的 Spearman 相关性映射到激酶系统发育树上。(F) 火山图显示脑区和非脑组织中与蛋白质周转增加(相应蛋白质不稳定)或延迟(相应蛋白质稳定)相关的 P 位点。
他们重点研究了微管相关蛋白Tau和α-突触核蛋白(SNCA)——这两种在神经退行性疾病中起关键作用的蛋白。通过DeltaSILAC分析发现,Tau蛋白S522和T525位点的磷酸化分别使其在大脑各区域的PT显著延长7.24天和9.20天;同样,SNCA蛋白T81位点磷酸化平均延长其PT达13.20天(图7A)。这与既往研究一致:过度磷酸化的Tau会促进其聚集成对螺旋纤维缠结,从而影响蛋白降解过程,提示去磷酸化可能具有治疗潜力;而SNCA磷酸化也影响其聚集性和神经毒性。
在验证实验中,他们采用最新开发的磷酸化靶向嵌合体(PhosTAC)技术,通过诱导Tau与活性PP2A全酶接近来促进其去磷酸化。与诱导蛋白降解的PROTAC不同,PhosTAC能快速持续地诱导蛋白去磷酸化。实验首先证实PhosTAC可下调Tau多个磷酸化位点,随后在重标SILAC培养基中检测发现:PhosTAC处理后Tau的H/L比值显著降低,表明去磷酸化可加速Tau降解(即缩短PT)(图7B)。另一独立验证中,他们在原代啮齿动物皮层神经元中过表达野生型及磷酸模拟突变体(Tau的T522D/T525D、SNCA的T81D),通过放线菌酮阻断后成像测定其半衰期(图7C)。结果显示:SNCA的T81D突变使其半衰期延长3.81倍,Tau磷酸模拟突变也呈现类似效应。
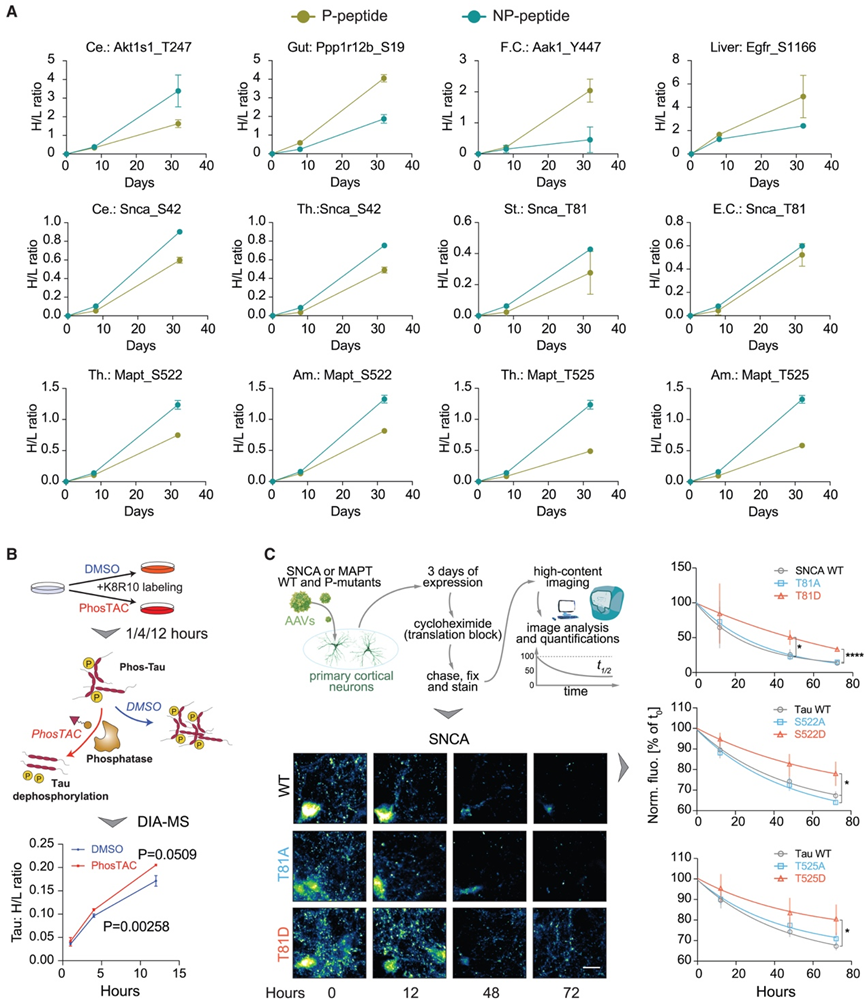
图7. 小鼠组织中与蛋白质周转相关的磷酸化位点的演示和验证。
(A) 小鼠组织中与蛋白质周转相关的磷酸化位点的演示和验证。(B) 使用 PhosTAC 验证磷酸化对 Tau 蛋白的影响。(C) 使用 PhosTAC 验证磷酸化对 Tau 蛋白的影响。
+ + + + + + + + + + +
结 论
本研究展示了Turnover-PPT平台,使用先进的蛋白质组学和稳定同位素标记技术,绘制了 8 种小鼠组织和不同脑区中 11000 种蛋白质和 40000 个磷酸位点的丰度和半衰期图谱,揭示了组织特异性的短半衰期和长半衰期蛋白质、相互作用蛋白质半衰期之间的强相关性以及磷酸化对蛋白质周转的不同影响。值得注意的是,他们发现特定组织中过氧化物酶体蛋白的周转变化模式显著,并且磷酸化调节神经退行性相关蛋白质(如 Tau 和 α-突触核蛋白)的稳定性。
+ + + + +



 English
English


