文献解读|Nat Med(50):APOE ε4 携带者在神经退行性疾病中均存在免疫相关蛋白质组学变化
✦ +
+
论文ID
原名:APOE ε4 carriers share immune-related proteomic changes across neurodegenerative diseases
译名:APOE ε4 携带者在神经退行性疾病中均存在免疫相关蛋白质组学变化
期刊:Nature Medicine
影响因子:50
发表时间:2025.07.15
DOI号:10.1038/s41591-025-03835-z
背 景
载脂蛋白 E 的 ε4 变体 (APOE ε4) 基因为是晚发型阿尔茨海默病 (AD) 1 的最大遗传风险因素。然而,越来越多的证据表明,APOE ε4 携带者也可能与其他年龄相关的神经退行性疾病有关。研究表明,APOE ε4与额颞叶痴呆 (FTD)、帕金森病 (PD)和肌萎缩侧索硬化症 (ALS) 的风险增加和发病年龄降低有关。APOE ε4还与PD患者的认知能力下降速度更快和认知能力较差有关,从而增加PD痴呆(PDD)的风险。虽然APOE ε4具有有害影响,但人们对其背后的生物学机制以及它在不同的神经退行性疾病中是否会发生变化或如何发生变化知之甚少。最近的研究表明,APOE ε4 携带者,无论其认知状态如何,无论是阿尔茨海默症 (AD) 还是轻度认知障碍 (MCI),其脑脊液 (CSF) 中的蛋白质组学特征均与促炎性免疫分子表型相关。然而,这种现象是否也适用于其他神经退行性疾病尚不清楚。
实验设计
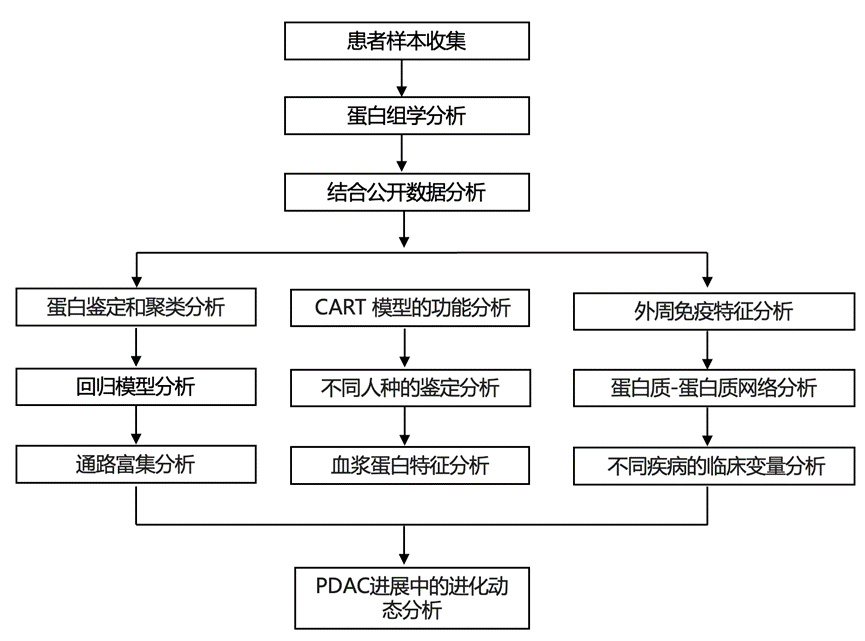
结 果
01
脑脊液蛋白质组分析揭示了APOE ε4 携带者的独特特征
为了鉴定与罹患神经退行性疾病的APOE ε4 携带者相关的全身性蛋白质组学变化,研究团队使用了全球神经退行性疾病蛋白质组学联盟 (GNPC) 数据集。他们使用 SomaScan 检测方法对 11270 名患有AD、FTD、PD、PDD、ALS 的APOE ε4 携带者和非携带者以及健康对照者的血浆和脑脊液蛋白质组进行分析。通过监督式机器学习,他们鉴定并表征了脑脊液和血浆中的APOE ε4 蛋白质组特征。随后,确认了外周APOE ε4 富集通路是否在携带者和非携带者的大脑中存在。使用非标记质谱 (MS) 测量了来自加速 AD 药物伙伴关系 (AMP-AD) UPenn 蛋白质组学研究中的 262 名 AD、FTD、PDD、ALS 和无损伤对照捐赠者的背外侧前额皮质 (dlPFC) 蛋白质组。在这些样本中,他们还检测了死后组织病理学标志物,包括淀粉样β斑块、tau 神经原纤维缠结、神经胶质增生和血管病的存在。在 FTD 和 ALS 病例中,他们检测了 TDP-43,而在 PD 和 PDD 病例中,他们检测了 α-突触核蛋白。最后,为了评估APOE ε4 标记中的蛋白质与疾病中环境变量之间的潜在相互作用,他们对蛋白质与 GNPC 数据集中收集的 18 个临床和生活方式变量(如高血压、吸烟和糖尿病)进行了相关网络分析(图1a)。
他们使用了来自 GNPC 数据集的 SomaScan(每个样本测量 6340 种蛋白质)蛋白质组学数据来分析 526 名 AD 患者、247 名 PD 患者和 573 名未受损对照个体的 CSF 蛋白质组。初始主成分分析 (PCA) 显示所有 6340 种蛋白质均未出现聚类(图1b)。他们使用互信息(>0.01)来鉴定APOE ε4 蛋白。与仅捕获线性关系的传统相关系数不同,互信息可以检测线性和非线性关联。这使得它非常适合复杂的高维生物数据,其中变量之间的关系可能不遵循简单的模式。通过这种方式,他们鉴定出 229 种与未受损对照中的APOE ε4 相关的 CSF 蛋白。随后的主成分分析 (PCA) 显示,这些蛋白质基于APOE基因型(图1c)和APOE ε4 等位基因数量形成了独特的聚类(图1d),且与疾病无关。热图进一步可视化了这一效应,显示APOE ε4 蛋白的上调或下调基于基因型而非疾病(图1e)。早期对阿尔茨海默症神经影像计划 (AD) 队列中患有轻度认知障碍和阿尔茨海默症的APOE ε4 携带者脑脊液蛋白质组进行分析时,也发现了许多此类APOE ε4 蛋白,这进一步凸显了本项研究结果的稳健性和普遍性。
使用分类和回归树 (CART) 模型,发现这 229 种 CSF 蛋白能够可靠地(性能指标 > 0.95)预测AD 和 PD 患者的APOE ε4 携带者和非携带者(图1f)。他们还发现,所鉴定的蛋白质在区分APOE ε4 携带者和非携带者的能力方面没有性别差异(图1f)。为了确定APOE ε4 特征是否可能是由于携带者和非携带者之间的淀粉样蛋白-β 水平差异造成的,他们检测了在 SomaScan 检测中测得的 CSF 淀粉样蛋白-β A4 蛋白水平。Wilcoxon 检验表明,在患有 AD、PD 或健康对照的APOE ε4 携带者和非携带者之间 ,CSF 淀粉样蛋白-β A4 蛋白水平没有显著差异。
利用进化关系分析 (PANTHER) 数据库对脑脊液APOE ε4 蛋白进行功能富集分析,结果显示病毒过程、细胞凋亡、节律性、细胞过程、蛋白质磷酸化和折叠以及 RNA/DNA 过程均显著富集(图1g)。鉴于病毒过程的富集最为显著,他们还对免疫途径特异性过程进行了富集分析。免疫特异性京都基因与KEGG通路显示,APOE ε4 蛋白在多种感染相关通路中富集,包括肝炎、疱疹、麻疹、爱泼斯坦-巴尔病毒 (EBV) 和甲型流感。T 细胞、B 细胞和炎症信号级联也显著富集,包括 Toll 样受体 (TLR)、肿瘤坏死因子 (TNF)、白细胞介素 17 (IL-17)、JAK/STAT 和核因子-κB (NF-κB)(图1h)。使用来自人类蛋白质图谱的单细胞 转录组分析数据,他们对APOE ε4 蛋白进行了免疫细胞亚型富集分析。在先天免疫细胞中,APOE ε4 蛋白在非经典和中间单核细胞中的富集最为丰富。在适应性免疫细胞中,记忆性 CD8 T 细胞是APOE ε4 蛋白最富集的细胞,其次是调节性T 细胞和记忆性 CD4 T 细胞。在先天样 T 细胞和淋巴细胞(混合)中,自然杀伤 (NK) 细胞和 γδ T 细胞均显示APOE ε4 富集(图1i)。鉴于发现了肝炎 KEGG 通路的富集,他们还在肝脏中进行了细胞类型特异性富集分析。在实质细胞中,APOE ε4 蛋白在肝细胞和库普弗细胞中富集程度最高,这与这两种细胞类型都是肝脏中 APOE4 蛋白质变体的主要产生者相符(图1j)。
这些结果表明,APOE ε4 携带者具有独特的脑脊液 (CSF) 蛋白质组学特征,其特征是病毒过程以及促炎免疫通路和细胞的富集。他们发现肝细胞和肝脏库普弗细胞中存在富集,进一步提示 APOE4 蛋白质变体的合成位点位于外周。这一发现也可能反映了脑-肝信号传导以及肝脏对神经炎症的反应。值得注意的是,这些变化与神经退行性疾病和性别无关,这表明APOE ε4 携带者具有共同的分子表型。
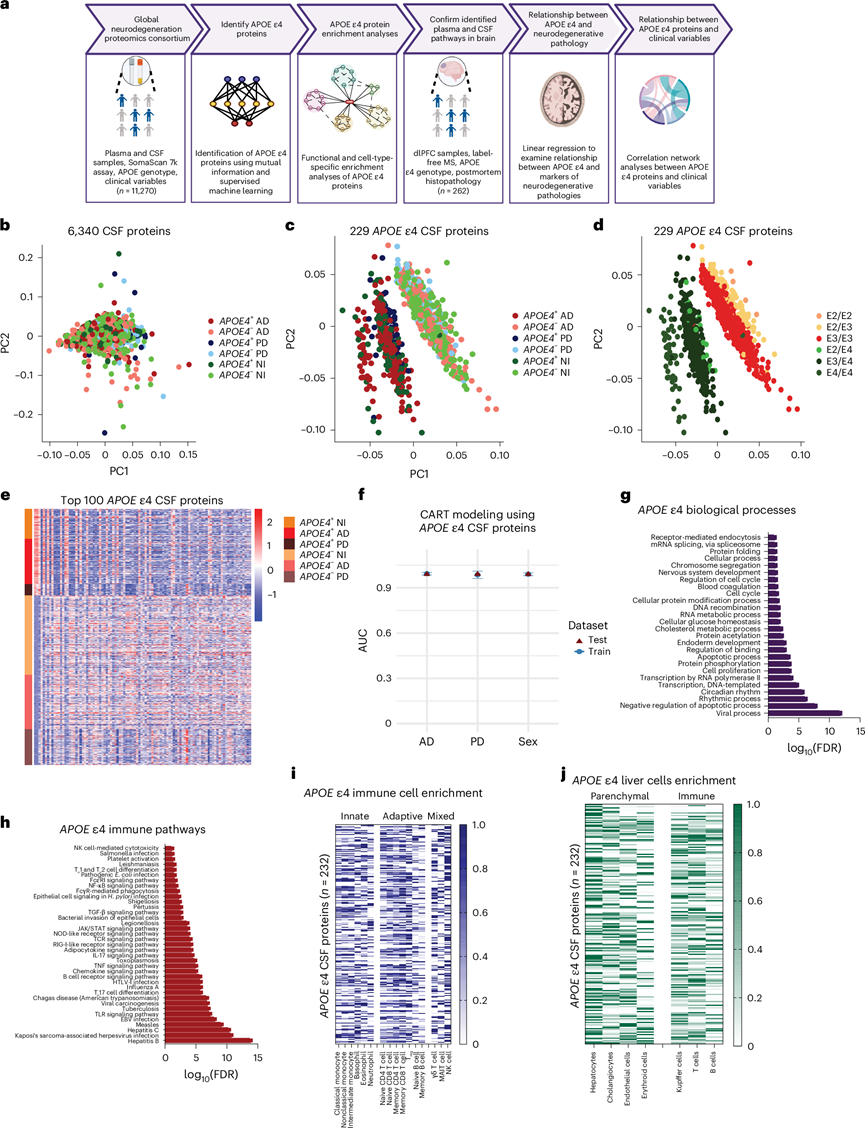
图1. APOE ε4 携带者 CSF 蛋白质组特征的研究设计和表征。
(a) 使用 GNPC 和 AMP-AD UPenn 蛋白质组学研究队列进行的研究设计,用于识别和表征APOE ε4 携带者的系统性蛋白质组变化。(b) 所有 6340 种CSF 蛋白的PCA显示没有明显的聚类。(c) 229 种APOE ε4 CSF 蛋白的 PCA。(d) 229 种APOE ε4 CSF 蛋白的 PCA显示聚类基于特定的APOE基因型和APOE ε4 等位基因的数量。(e) 热图可视化了 229 种蛋白质的APOE ε4 CSF 蛋白质组特征中蛋白质的上调(红色)和下调(蓝色),显示了基于APOE ε4 等位基因的存在。(f) 使用 CART 的监督机器学习模型显示了重复五次的五倍平均 AUC ± sd。(g) 对富集了APOE ε44 CSF 蛋白的 PANTHER 生物过程的功能富集分析显示病毒过程的富集最为显著。(h) 功能富集分析,显示免疫、感染和促炎通路的富集显著。(i) APOE ε4 CSF 蛋白的免疫细胞类型特异性富集分析。(j) APOE ε4 CSF 蛋白的肝细胞类型特异性富集分析,显示实质细胞和免疫细胞均参与其中。
02
血浆蛋白质组分析揭示了相似的APOE ε4 特异性特征
他们接下来试图确定观察到的APOE ε4 CSF 蛋白质组变化是否也反映在血浆中。进一步利用 GNPC 数据集,对 2929 名 AD 患者、75 名 FTD 患者、169 名 PDD 患者、422 名 PD 患者、230 名 ALS 患者和 6099 名未受损对照个体(携带和不携带APOE ε4 等位基因)进行了血浆蛋白质组分析。对所有 6340 种蛋白质进行 PCA 分析后发现,它们没有组聚类(图2a)。利用相互信息,在未受损对照中鉴定出 58 种血浆蛋白质,这些蛋白质与APOE基因型相关(图2b),并基于APOE ε4 等位基因数量而进行聚类(图2c)。热图还显示,58 种APOE ε4 血浆变化根据基因型呈上调或下调趋势(图2d)。其中两种蛋白质 TBCA 和 LRRN1 也在健康APOE ε4 百岁老人的血清中鉴定出来,这进一步验证了本研究的发现以及这些蛋白质在APOE ε4 携带者中的重要性。
使用这 58 种蛋白质作为预测因子的 CART 模型显示出在各个神经退行性疾病组中对APOE ε4 携带者和非携带者进行区分的强大能力。CART 建模表明APOE ε4 血浆特征没有性别差异(图2e)。他们对此进行了扩展,以表明种族没有影响。针对白人个体训练了本研究的模型,并使用黑人/非裔美国人或美洲印第安人/阿拉斯加原住民的蛋白质组学数据对它们进行了测试。在这两种情况下,本研究的模型都能可靠地预测APOE ε4 携带者和非携带者(图2e)。他们还比较了神经退行性疾病中APOE ε4 携带者和非携带者的淀粉样β蛋白 A4 蛋白水平,以确定血浆APOE ε4 特征是否与淀粉样β病理相关。Wilcoxon 检验显示, APOE ε4 携带者和非携带者的血浆淀粉样β蛋白 A4 没有显著差异。
APOE ε4 血浆过程显著富集了生物学过程,包括细胞凋亡、细胞过程、蛋白质过程和 RNA/DNA 过程(补充表5)。与 CSF 一样,病毒过程是最显著富集的生物学过程(图2f)。KEGG 免疫和感染途径的类似富集进一步支持了这一点,包括 EBV 和肝炎(图2g)。炎症和细胞因子信号通路也显著富集,包括 TNF、IL-17、TLR 和 NF-κB(图2g和补充表5 )。在免疫细胞亚型中,非经典和中间单核细胞与APOE ε4 蛋白有关,如在 CSF 中所见。然而,与 CSF 不同的是,嗜碱性粒细胞富含APOE ε4 蛋白。在适应性免疫细胞亚型中,血浆APOE ε4蛋白在记忆性CD8 T细胞、调节性T细胞和幼稚CD8 T细胞中富集。NK细胞和γδT细胞也与APOE ε4相关(图2h)。在肝脏中,他们发现细胞类型特异性富集主要为库普弗细胞和T细胞,而与脑脊液不同,肝细胞的富集非常少。
在脑脊液 (CSF) 中观察到的基因型特异性蛋白质组学变化也反映在APOE ε4 携带者和非携带者的血浆中,这一致表明多种途径和免疫细胞群存在促炎性免疫失调。APOE ε4蛋白质组学特征与神经退行性疾病状态和性别无关,CART 模型显示出对携带者状态的强大预测能力。进一步表明,该特征在不同种族群体中具有普遍性,凸显了其稳健性和广泛的适用性。与脑脊液不同,血浆APOE ε4 蛋白并未在肝细胞中富集,但在库普弗细胞和 T 细胞中显著富集,这表明在APOE ε4 携带者中,外周免疫激活与肝脑轴上的中枢神经系统 (CNS) 免疫代谢信号传导不同。
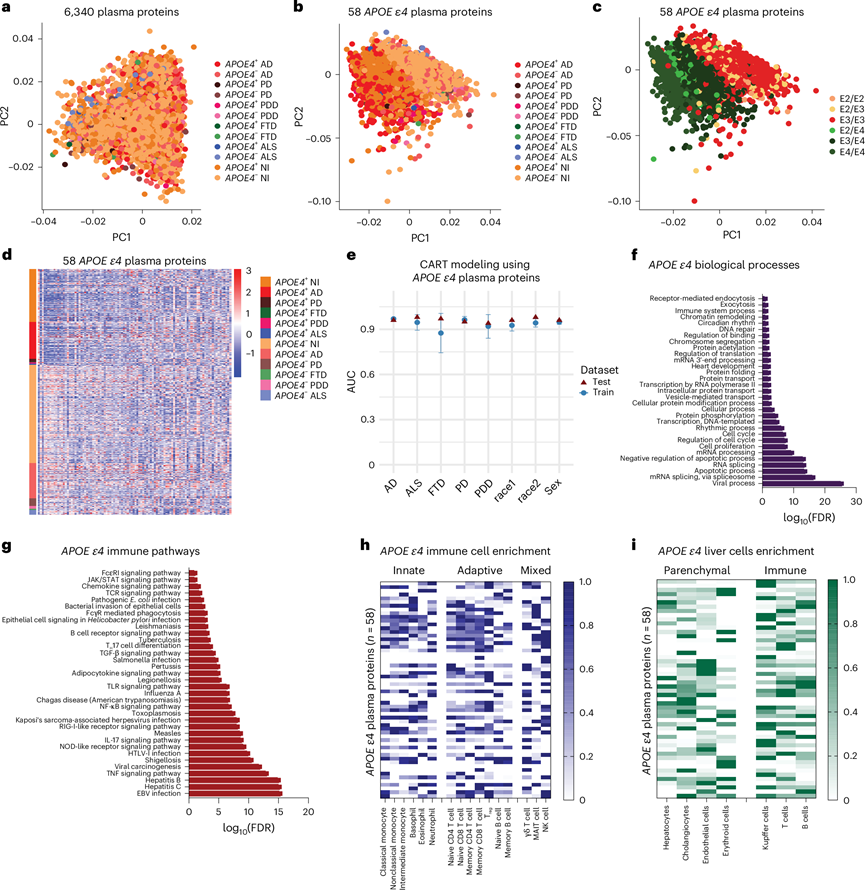
图2. APOE ε4 携带者的血浆蛋白质组特征的鉴定和表征。
(a) 对所有 6340 种测量的血浆蛋白进行 PCA 分析,结果显示没有明显的聚类。(b) 使用相互信息识别的 58 种APOE ε4 血浆蛋白的PCA显示聚类是基于APOE ε4 等位基因的存在与否而不是特定的神经退行性疾病。(c) 58 种APOE ε4 血浆蛋白的 PCA显示聚类是基于特定的APOE基因型和APOE ε4 等位基因的数量。(d) 热图可视化了 58 种蛋白质的APOE ε4 血浆蛋白质组特征中蛋白质的上调(红色)和下调(蓝色)。(e) 使用 CART 进行监督机器学习建模,显示重复五次的五倍平均 AUC ± sd。(f)功能富集分析,结果显示病毒过程的富集最为显著。(g) 功能富集分析,结果显示免疫、感染和促炎途径的富集显著。(h) 对APOE ε4 血浆蛋白进行免疫细胞类型特异性富集分析,结果显示涉及先天性、适应性和先天样 T 细胞和淋巴细胞。(i) 肝细胞类型特异性APOE ε4 脑脊液蛋白富集分析,显示其参与了实质细胞和免疫细胞。
03
APOE ε4 携带者的大脑反映了外周免疫特征的关键特征
他们随后试图确定在周围观察到的蛋白质组学变化是否反映了APOE ε4 携带者的中枢变化,并进一步验证从 GNPC 队列中获得的发现。为此,他们利用了 AMP-AD UPenn 蛋白质组学研究中的非标记 MS 蛋白质组学和死后组织病理学数据,该研究针对 49 名 AD 患者、31 名 FTD 患者、47 名 PDD 患者、33 名 PD 患者、55 名 ALS 患者和 47 名未受损个体捐赠者的 dlPFC。SomaScan 和非标记 MS 蛋白质组学分析对特定蛋白质的覆盖率不同;因此,他们专注于确认携带者和非携带者的 CSF、血浆和 dlPFC 中生物过程和通路的富集情况。再次使用相互信息来独立识别每组内 dlPFC 中的APOE ε4 蛋白。在所有神经退行性疾病组中,鉴定了 248 种APOE ε4 蛋白。功能富集分析表明,在脑脊液和血浆中鉴定的三种主要生物学过程(病毒过程、凋亡的负调控和蛋白质折叠)也在所有神经退行性疾病的APOE ε4 携带者的 dlPFC 中显著富集(图3a-b)。此外,在APOE ε4 携带者的脑脊液和血浆中富集最显著的四种 KEGG 免疫通路也以与疾病无关的方式鉴定出来,包括 EBV、乙型肝炎、病毒致癌作用和致病性大肠杆菌感染(图3b-c)。
先前的研究表明,即使没有出现症状,APOE ε4 携带者也可能出现神经退行性病变,包括淀粉样β蛋白斑块和 tau 神经原纤维缠结。因此,他们试图确定APOE ε4 携带者身上出现的变化是否可能是由于APOE ε4 驱动的脑病变所致。在未受损的对照组和疾病组中,APOE ε4 与 tau 或硫代-S 阳性斑块之间没有关系。在 FTD、PDD 和 PD 中, APOE ε4 与 α-突触核蛋白之间也没有关系。
综上所述,这些发现表明外周和中枢蛋白质组学变化之间存在关联。两者均以促炎性免疫反应为特征,进一步凸显了APOE ε4 携带者存在全身性免疫失调,这表明APOE ε4 携带者外周观察到的显著蛋白质组学变化确实反映了大脑中正在进行的生理过程,并且外周生理过程可能积极地促进甚至驱动大脑蛋白质组学的变化。值得注意的是,APOE ε4 相关变化与神经退行性疾病无关,无论是通过简单的诊断还是通过大脑中的特定病理变化来衡量。
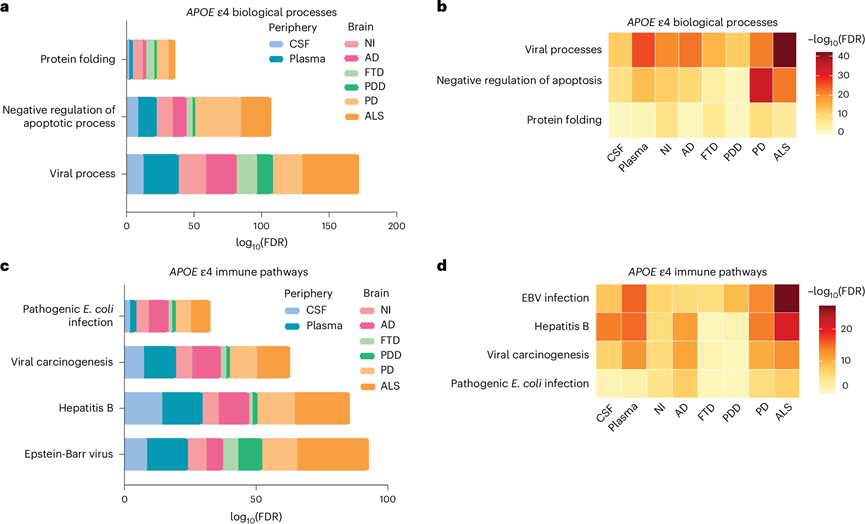
图3. 神经退行性疾病中APOE ε4 携带者的脑脊液、血浆和大脑中的关键重叠富集。
(a) 条形图比较了在脑脊液、血浆和脑(dlPFC)中富集APOE ε4 蛋白的重叠显著PANTHER 生物过程的。(b) 热图比较了PANTHER生物过程。(c) 在脑脊液、血浆和脑(dlPFC)中富集APOE ε4 蛋白的 KEGG 免疫相关通路。(d) 脑脊液、血浆和脑(dlPFC)中富集APOE ε4 蛋白的重叠显著 (FDR < 0.05) KEGG 免疫相关通路。
04
外周APOE ε4 相关蛋白与不同疾病的临床变量存在不同的相关性
鉴于神经退行性疾病中的APOE ε4 携带者都具有主要的共同全身蛋白质组学变化,他们力求更好地了解可能具有疾病特异性的其他驱动因素。为此,他们利用 GNPC 数据集和相关网络分析来确定APOE ε4 蛋白与人口统计学、临床和生活方式变量(例如年龄、血压和吸烟)之间的关系。在APOE ε4 携带者的脑脊液和血浆中重叠的 40 种蛋白质中,他们选择了其中具有 20 多个功能连接的 16 种蛋白质(图4a)。这些蛋白质代表蛋白质-蛋白质网络中的中心“节点”,表明任何变化都更有可能破坏不同的通路和功能。值得注意的是,两种重叠蛋白 APOE 和 PHGDH 在血浆和脑脊液中呈现出相反的差异表达。这两种蛋白在脑脊液中均上调,但在血浆中下调。由于他们拥有更多血浆样本的个体,从而提高了统计功效,相关性分析反映了血浆中 APOE 和 PHGDH 水平的下降。
他们首先分析了未受损、AD、PDD 和 PD APOE ε4 携带者的 APOE 与人口统计、临床和生活方式变量的 Spearman 等级相关性(连续变量)或相关比(分类变量)。由于数量少,无法分析 FTD 和 ALS 的类似相关性。他们发现了与 APOE 独特的、神经退行性疾病特异性的显著关系(图4b)。APOE 与 AD 中的性别和种族有关,与 PD 中的糖尿病有关,与 PDD 中的静息心率和慢性阻塞性肺病 (COPD) 有关,与未受损对照者的年龄、体重指数和高血压有关。一个关键的限制是缺乏未受损APOE ε4 携带者的纵向数据,他们以后可能患上神经退行性疾病。因此,观察到的与临床变量的关联可能反映了临床前疾病。他们将这些相关性分析扩展到其余 15 种中心节点APOE ε4 蛋白。该分析进一步发现,APOE ε4 中心节点蛋白与APOE ε4 携带者 的人口统计、临床和生活方式变量以疾病特异性的方式显著相关(图4c)。
所有APOE ε4 携带者,无论患有何种神经退行性疾病,都具有独特的蛋白质组特征,该特征扩展到血浆和脑脊液。与前瞻性设计的队列不同,GNPC 数据集反映了真实世界的临床异质性,凸显了本研究结果的稳健性和普遍性。这种特征与促炎性免疫失调和循环免疫细胞的富集有关,包括单核细胞、记忆 CD8 和 γδ T 细胞、T reg 细胞和 NK 细胞。这种分子表型以类似的与疾病无关的方式延伸至APOE ε4 携带者的大脑,并且与任何疾病特异性脑病理的存在无关(图5)。
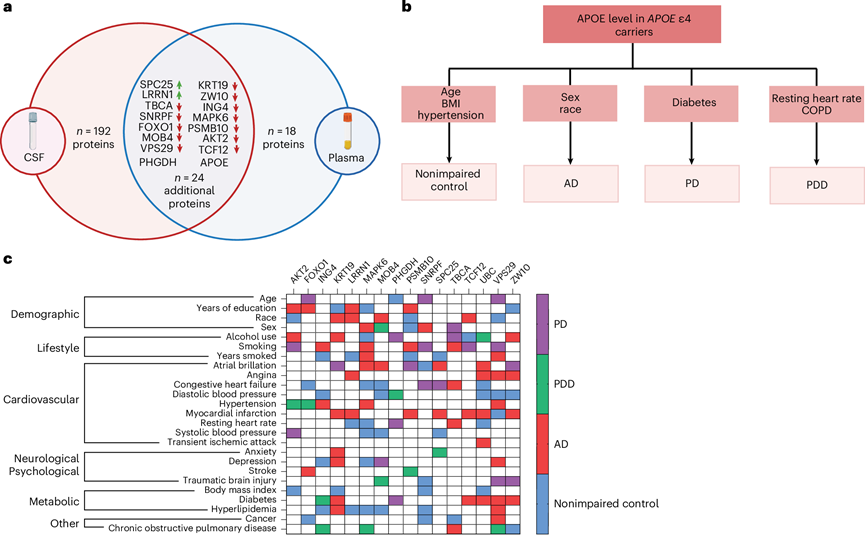
图4. APOE ε4 CSF 和血浆中心节点蛋白与人口统计、生活方式和临床变量之间的相关性分析。
(a) 维恩图显示在脑脊液和血浆中发现的重叠APOE ε4 蛋白。(b) 层次树显示 APOE 与人口统计和临床变量之间独特的神经退行性疾病特异性关系。(c) 分类热图显示其余 15 种中心节点 APOE ε4 蛋白与人口统计、生活方式和临床(心血管、神经/心理、代谢和其他)变量之间独特的神经退行性疾病特异性关系。
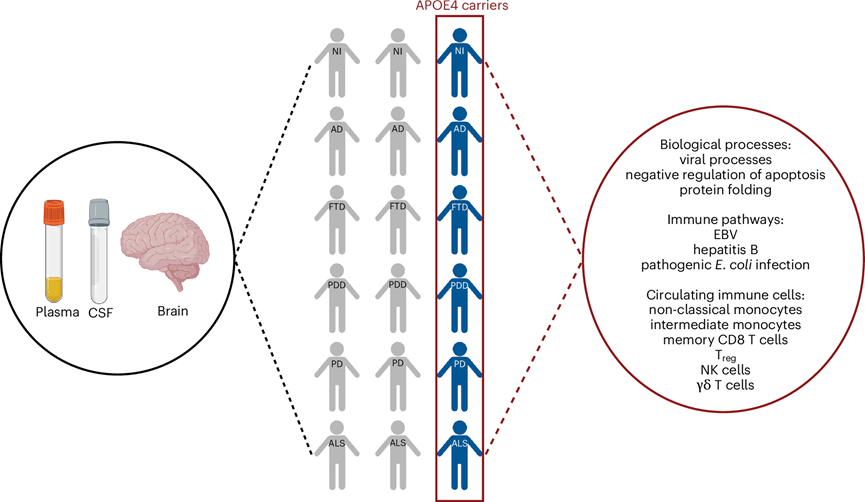
图5. 研究结果摘要。
+ + + + + + + + + + +
结 论
本研究利用全球神经退行性疾病蛋白质组学联盟 (Global Neurodegeneration Proteomics Consortium) 的 SomaScan 数据集,该数据集涵盖 1346 份CSF和9924 份血浆样本,并基于机器学习的蛋白质组分析,鉴定出一种在AD、FTD、PDD、PD、ALS患者和健康对照者之间共有的 APOE ε4 蛋白质组特征。该特征在促炎性免疫和感染通路以及免疫细胞(包括单核细胞、T 细胞和自然杀伤细胞)中富集。对来自“加速阿尔茨海默症药物合作计划”(Accelerating Medicines Partnership for AD)宾夕法尼亚大学蛋白质组学研究的262名捐赠者的背外侧前额叶皮质蛋白质组进行分析,结果显示APOE ε4表型一致,且与神经退行性病变无关,包括所有疾病中的β淀粉样蛋白tau和神经胶质增生,以及ALS和FTD病例中的TDP-43,以及PD和PDD病例中的α-突触核蛋白。虽然APOE ε4携带者的全身蛋白质组学变化一致,但它们与高血压和吸烟等临床和生活方式因素的关系因疾病而异。这些发现表明,APOE ε4赋予全身性生物学易感性,这种易感性对于神经退行性病变而言是必要而非充分的,这强调了需要考虑基因与环境相互作用的必要性。总体而言,本研究揭示了一种保守的APOE ε4相关促炎免疫特征,该特征在脑、脑脊液和血浆中持续存在,且与神经退行性疾病无关,这突显了神经退行性疾病存在一种与疾病无关的、根本性的生物学易感性。这项研究将APOE ε4重新定义为一种多效性免疫调节剂,而非AD特异性风险基因,为神经退行性疾病的精准生物标志物开发和早期干预策略奠定了基础。
+ + + + +



 English
English


